ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1125
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
а) методы окраски: по Граму или без окраски;
б) микрокартина:
- в пораженных тканях и гное возбудитель обнаруживается в виде зерен (друзы), которые состоят из нитей, расходящихся от центра в виде лучей, величина составляет от 60 до 100 мкм (рис. 130);
в) грамположительные;
г) образуют споры;
д) капсулу не образуют;
е) неподвижны.
3. Культивирование:
а) посев на питательные среды: среда Сабуро, глюкозо-кровяной агар;
б) особенности выделения возбудителя:

Рис. 130. Возбудитель актиномикоза в гное. Друзы лучистого гриба и отдельные колбы. Увеличение х400
- факультативные анаэробы (5-10% СО2);
- оптимальная температура 37°С;
- срок культивирования 15-30 дн.
в) культуральные свойства:
- колонии пигментированные гладкие или шероховатые, пушистые или мучнистые,
- в приготовленных препаратах при микроскопии – несептицированный мицелий до 100 мкм и более, видны споры.
г) биохимические свойства:
- обладает сахаролитическими свойствами;
- протеолитические свойства характеризуются разжижением желатины, образованием сероводорода и пептонизацией молока.
4. Биопроба:
- заражают внутрибрюшинно молодых белых мышей, морских свинок, кроликов и др.
Б, В. Серологические и аллергические методы:
- не используются.
5,6. Биопрепараты для специфической профилактики и терапии:
- не разработаны.
Задания для самостоятельной работы
1. Изучить культуральные особенности возбудителя актиномикоза.
2. Изучить морфологию возбудителя актиномикоза на демонстрационных препаратах.
3. Изучить микологическую диагностику актиномикоза.
Тема 44. Возбудитель сапа
ЦЕЛЬ ЗАНЯТИЯ. Изучить свойства возбудителя и методы микробиологической диагностики сапа.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Для демонстрации нужны таблица-схема микробиологической диагностики сапа, готовые препараты для микроскопии. Маллеин.
При подготовке к занятию необходимо уяснить следующие вопросы:
1. Морфологические, тинкториальные и культуральные особенности возбудителя.
2. Методы микробиологической диагностики сапа.
1. Классификация возбудителя
Сем.: Pseudomonadaceae
Род:. Pseudomonas
Вид: Ps. mallei
2. Общая характеристика болезни:
Сап – преимущественно хроническая инфекционная болезнь, характеризующаяся образованием специфических сапных узелков во внутренних органах и на слизистых и кожных покровах, при распаде которых образуются язвы.
3. Восприимчивые животные:
- в первую очередь, однокопытные животные (лошади, ослы, мулы), могут болеть верблюды, кошачьи (львы, пантеры, тигры, леопарды), болеет и человек
4. Патогенез и факторы вирулентности:
- возбудитель, попав в организм, гематогенным и лимфогенным путем проникает в легкие и другие органы;
- в местах локализации возбудителя формируется гранулема, на коже и слизистых оболочках образуются язвы с изрытыми краями и саловидным дном;
- основным фактором вирулентности являются эндотоксины.
Антигены возбудителя вызывают гиперчувствительность замедленного типа. Аллергическая диагностика проводится в хозяйствах.
Методы диагностики (рис. 131):

Рис. 131. Схема лабораторной диагностики сапа
А. Бактериологический метод:
1. Материал для исследования:
- пораженные органы, лимфоузлы, гнойное отделяемое язв.
2. Микроскопия:
а) методы окраски: простой метод (метиленовая синь), по Романовскому-Гимзе;
б) микрокартина: полиморфные палочки прямые или слегка изогнутые, длиною до 5 мкм (рис. 132);
в) грамотрицательные;
г) спор не образуют;
д) капсул не образуют:
е) неподвижны.
3. Культивирование
а) посев на питательные среды: среды с глицерином МПА, МПБ, картофель;
б) особенности выделения чистой культуры:
-аэробы;
-оптимальная температура 37°С;
-срок культивирования 18-20 ч.
в) культуральные свойства:
- на жидких средах: равномерное помутнение среды, образование пристеночного кольца и пленки;
- на плотных средах: слизистый серовато-белый налет, который приобретает коричневый цвет на глицериновом картофеле – вначале мелкие полупрозрачные с желтоватым оттенком колонии, затем они сливаются, образуя медообразный налет.
г) биохимические свойства:
- расщепляют многие углеводы с образованием кислоты;
- индола не образуют, желатину разжижают.
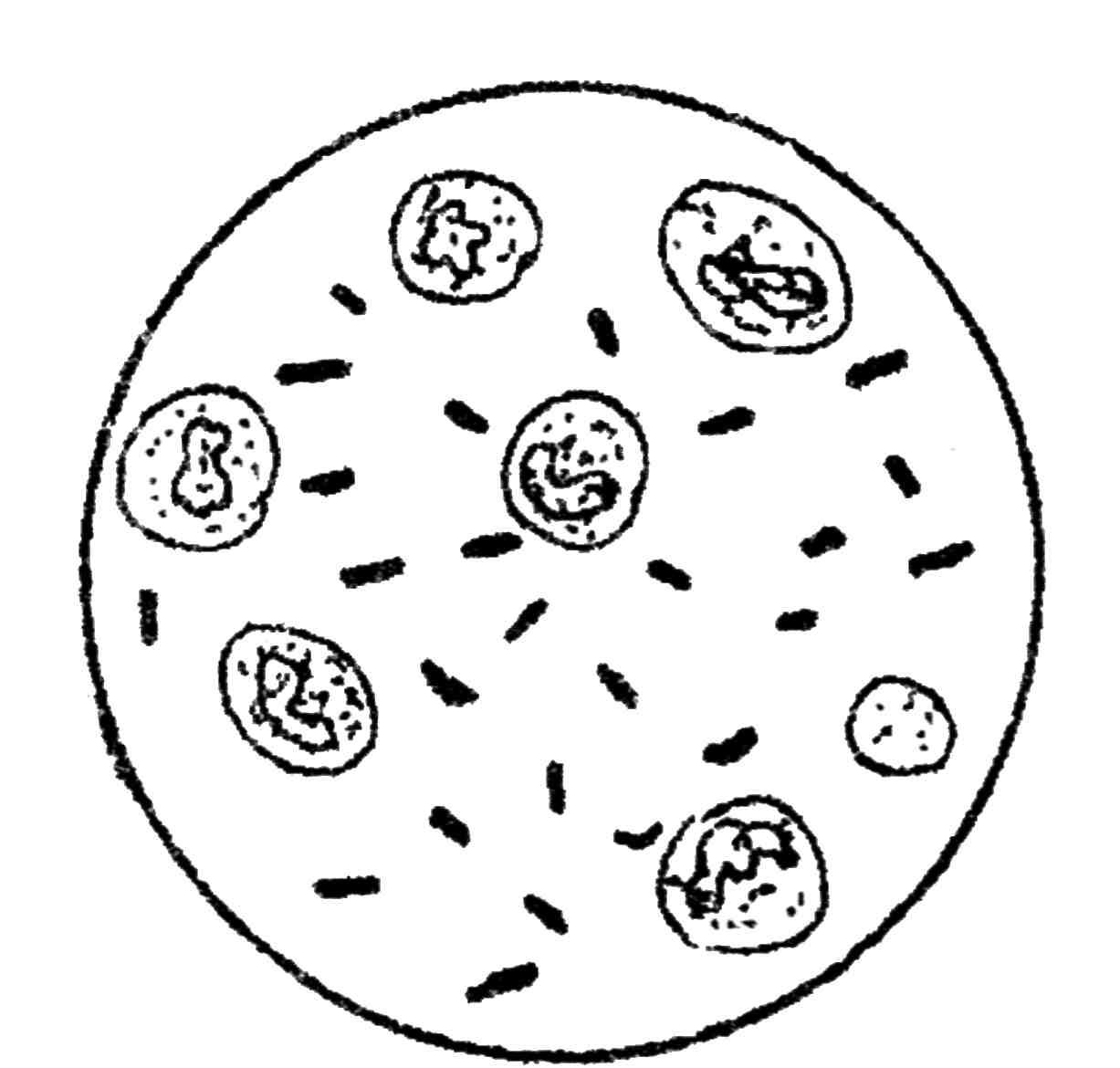
Рис. 132. Возбудитель сапа в гное из яичек самца морской свинки. Увеличение х900
4. Биопроба:
- заражают 2-3 золотистых хомячков или самца морской свинки, вводя материал подкожно, развивается орхит – феномен Штрауса (рис. 133).

Рис. 133. Орхит у самца морской свинки при сапе (феномен Штрауса)
Б. Серологическая диагностика:
- является основным методом и осуществляется путем постановки РСК.
В. Аллергическая диагностика:
- нашла широкое применение в виде маллеинизации: маллеин закапывают в конъюнктивальный мешок (глазной метод).
Положительная реакция характеризуется воспалением конъюнктивы и истечением гнойного секрета из внутреннего угла глаза.
5, 6. Биопрепараты для специфической профилактики и терапии:
- не разработаны.
Задания для самостоятельной работы
1. Изучить морфологические, тинкториальные, культуральные и биохимические свойства возбудителя.
2. Изучить схему микробиологической диагностики сапа.
3. Провести микроскопию демонстрационных препаратов возбудителя сапа.
4. Ознакомиться с аллергическим методом диагностики сапа.
Тема 45. Возбудитель лептоспироза
ЦЕЛЬ ЗАНЯТИЯ. Изучить свойства возбудителя и методы микробиологической диагностики лептоспироза.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Для демонстрации необходимы таблицы, пробирки с культурой лептоспир (сапрофиты), готовые препараты-мазки, окрашенные методом Романовского-Гимзе, и мазок, обработанный для люминесцентной микроскопии, МЛ-2, нефлюоресцирующее масло, биопрепараты, микроскоп и осветители ОИ-17, лептоспирозные агглютинирующие сыворотки, антигены для диагностики лептоспироза.
При подготовке к занятию необходимо уяснить следующие вопросы:
1. Основные типы лептоспир, их названия и патогенность.
2. Морфологические, тинкториальные и культуральные особенности лептоспир на жидких питательных средах.
3. Особенности бактериологической диагностики лептоспироза.
4. Серологическая диагностика лептоспироза и методика постановки микроагглютинации (РМА).
1. Классификация возбудителя
Сем.: Leptospiraceae
Род: Leptospira
Вид: L. interrogans (патогенные),
L. biflexa (непатогенные).
Имеется 18 серологических групп, в которые входят 170 различных серовариантов (серовары). Например, основными возбудителями у свиней являются лептоспиры Pomona, Tarassovi; у крупного рогатого скота Hebdomatiens, Pomona, Gripotyphosa, Tarassovi.
2. Общая характеристика болезни:
Лептоспироз – инфекционная природно-очаговая болезнь животных и человека, характеризующаяся у животных преимущественно бессимптомным течением, в типичных случаях – кратковременной лихорадкой, желтухой, гемоглобинурией, абортами и др. Зарегистрирована во многих странах, в т. ч. и в нашей стране. Летальность при клинически выраженной форме 20-25 %.
3. Восприимчивые животные:
- многие виды домашних и диких животных. Болеет и человек. Особая роль в распространении болезни принадлежит грызунам.
4. Патогенез и факторы вирулентности:
- основной фактор передачи болезни – инфицированная вода, в которую возбудитель попадает от больных и переболевших животных, а также лептоспироносителей,
- входные ворота – поврежденные слизистые оболочки,
- лизис лептоспир сопровождается выходом эндотоксинов, под действием которых повышается проницаемость сосудов и лизис эритроцитов, происходят кровоизлияния, развивается гематурия и желтуха, поражается нервная система. Токсикоз может привести к гибели животного.
Методы диагностики (рис. 134):
А. Бактериологический метод:
1. Материал для исследования
- при жизни – моча, кровь (в период лихорадки);
- посмертно: моча, кровь, паренхиматозные органы.

Рис. 134. Схема лабораторной диагностики лептоспироза
2. Микроскопия:
а) готовят препарат «раздавленная капля» и микроскопируют с использованием конденсора «темное поле». На темном фоне выявляются тонкие серебристо-белые извитые нити длиною от 6 до 30 мкм с утолщениями и загнутыми в виде крючков концами (рис. 135), плохо окрашиваются анилиновыми красками, по Романовскому-Гимзе – красные, используют также метод «серебрение» по Левадити;
б) грамотрицательные;
в) спор не образуют;
г) капсул не образуют:
д) активно подвижны.
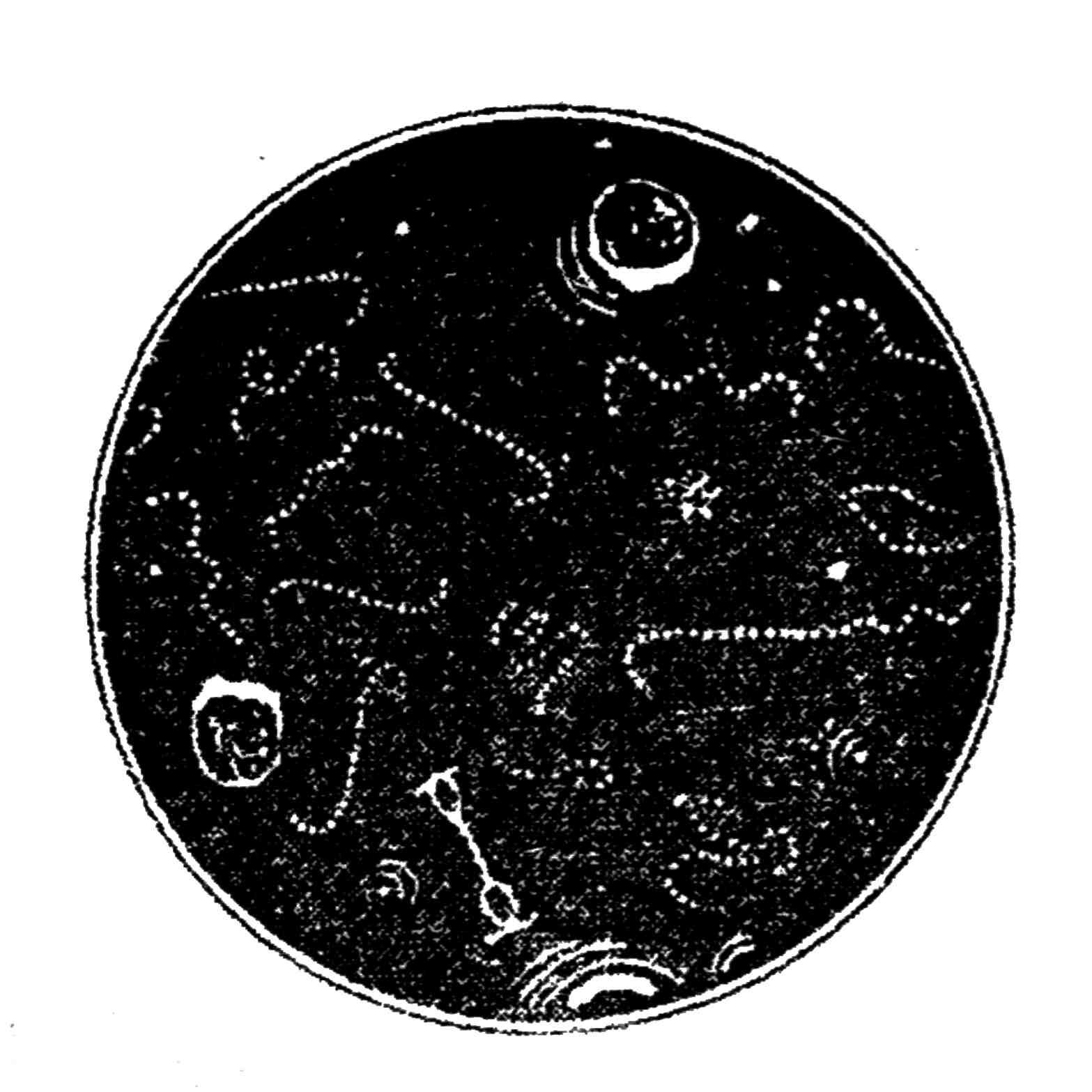
Рис. 135. Возбудитель лептоспироза в темном поле микроскопа из крови больного теленка. Увеличение х400
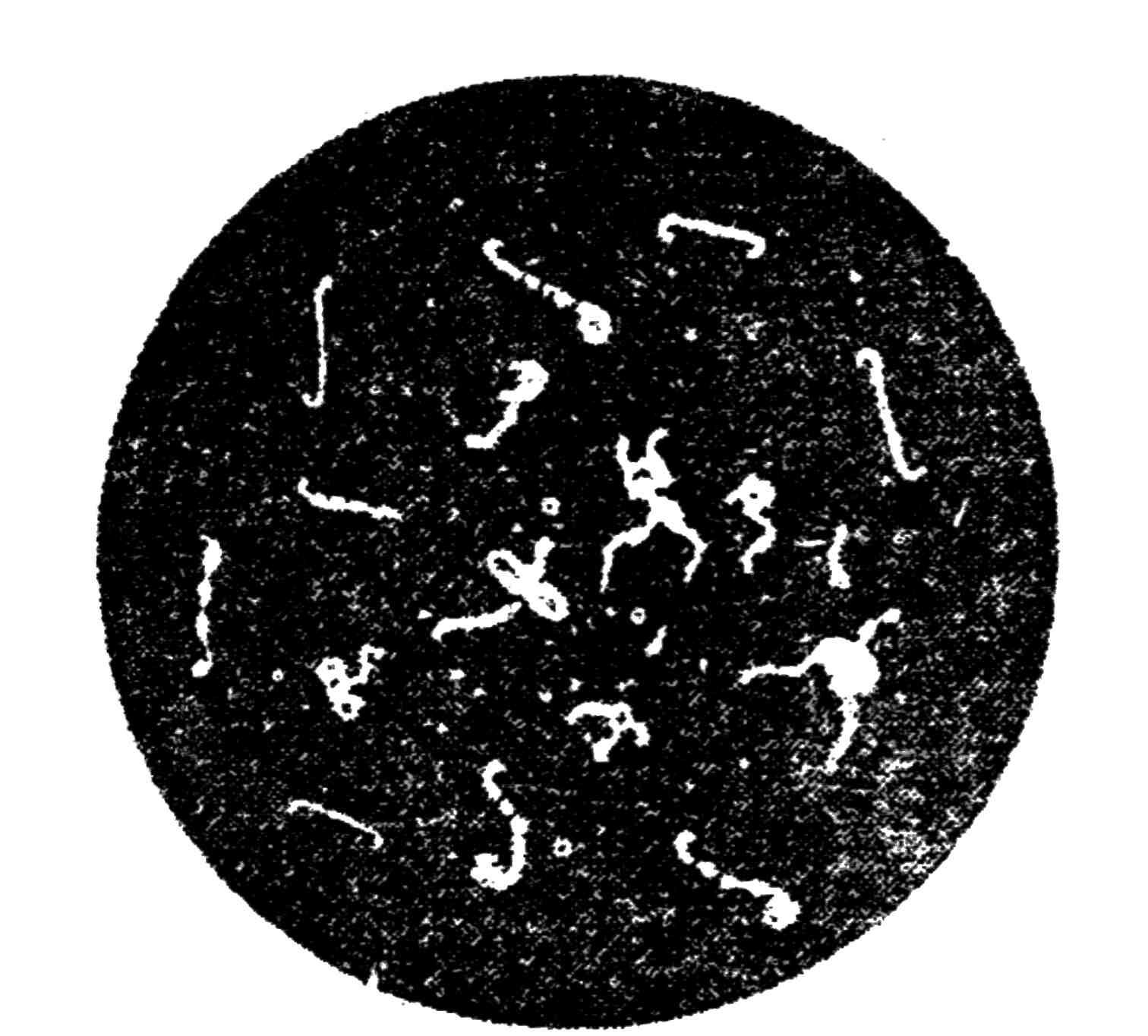
Рис. 136. Агглютинация лептоспир (образование «паучков» в РМА). Увеличение х400
3. Культивирование:
а) посев на питательные среды, в состав которых входит дистиллированная вода или водопроводная, или буферный раствор с 5-10 % сыворотки кролика;
б) особенности выделения чистой культуры:
- факультативные анаэробы;
- оптимальная температура 28-30°С;
- срок культивирования от 7 дней до 1-2 мес;
в) кулътуральные свойства:
на жидких средах – незначительное помутнение;
- рост определяют путем микроскопии в «темном поле».
г) биохимические свойства:
- изучены недостаточно.
4. Биопроба:
- заражают внутрибрюшинно золотистых хомячков (20-30-дневного возраста) или крольчат-сосунов (10-20-дневного возраста).
Б. Серологическая диагностика:
- используют РМА (реакцию микроагглютинации) и РА.
РМА ставят в лунках агглютинационных пластинок, компоненты:
1) сыворотка в разведении 1:100, 1:500, 1:2500 в объеме 0,1 мл;
2) антиген – живые культуры лептоспир различных серогрупп в объеме 0,1 мл. Реакция происходит в течение 1 часа при 30°С.