ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1188
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Ряд веществ биологического происхождения — хлорофилл, витамин В2, алкалоиды, некоторые антибиотики и другие соединения обладают собственной (первичной) люминесценцией. В зависимости от содержания таких веществ в клетке некоторым дрожжам и бактериям также свойственна первичная люминесценция. Однако клетки большинства микроорганизмов люминесцируют очень слабо, поэтому их обрабатывают специальными красителями - флюорохромами. Такая наведенная люминесценция называется вторичной.
Люминесцентные микроскопы и люминесцентные устройства, как правило, состоят из трех основных частей: 1) мощный источник света; 2) осветительное устройство и 3) микроскоп. Источником света служат ртутно-кварцевые лампы сверхвысокого давления. Главной составной частью осветительного устройства является система светофильтров, позволяющая выделить из источника света нужные части спектра для возбуждения люминесценции (ультрафиолетовые, синие, фиолетовые лучи). Микроскоп состоит из тех же составных частей, что и обычный биологический микроскоп.
При люминесцентной микроскопии исследуемые объекты (микроорганизмы) видны потому, что они становятся светящимися, а при световой микроскопии мы видим объекты в результате отражения, преломления света.
В настоящее время выпускаются различные люминесцентные микроскопы – МЛ-1, МЛ-2, МЛ-3, МЛ-4, ЛюМАМ, а также люминесцентные устройства, которые монтируются на обычный световой микроскоп, такие, как ОИ-17, ОИ-28 и др. Для иммерсионной микроскопии при люминесцентном исследовании используют специальное нефлюоресцирующее масло, заменяют его диметиловым эфиром фталиевой кислоты или дистиллированную воду.
Для получения эффекта вторичной люминесценции используют: 1) метод простого флюорохромирования (МФ) и 2) методы флюоресцирующих антител (МФА, иммунофлюоресценция).
Метод флюорохромирования. По технике выполнения этот метод не отличается от методов обычной окраски мазков, применяемых при световой бактериоскопии. Для этих целей используют краски, которые светятся в момент облучения их ультрафиолетовыми лучами. Такие краски называются флюорохромами, а окраска ими – метод флюорохромирования. К флюорохромам относятся такие красители, как акридин оранжевый, акридин желтый, аурамин, флюоресцеин, нейтральный красный, риванол и др. Продается специальный «Набор красителей для флюоресцентной микроскопии», содержащий 20 красителей. Флюорохромы растворяют в дистиллированной воде (1:500-1:100000). Такие растворы малотоксичны, что дает возможность изучать живую клетку (микроорганизмы).
Препарат для метода простого флюорохромирования можно готовить двумя способами:
а) на свежий мазок-отпечаток (из органов, соскобов со слизистых оболочек) или суспензии инфицированных клеток наносят 1-2 капли рабочего раствора (1:10000) акридинового оранжевого, накрывают покровным стеклом. Приготовленный таким образом свежий (в течение 10-20 мин после его приготовления) препарат рассматривают в люминесцентном микроскопе;
б) мазки-отпечатки, полученные из патологического материала, или инфицированные культуры клеток (на предметных стеклах), фиксируют 96°-ным этиловым спиртом в течение 15-30 мин, промывают дистиллированной водой, наносят на препарат 1-2 капли раствора акридинового оранжевого (1:10000), через 5-10 мин покрывают покровным стеклом и исследуют.
В препаратах ДНК-содержащих вирусов, например аденовируса, вирусный материал светится зеленоватым цветом в ядре в виде гранул различной величины. При наличии в препарате РНК-содержащего вируса, например вируса гриппа, вирусный материал обнаруживается в виде ярко-красных гранул в цитоплазме клеток.
Методы флюоресцирующих антител (МФА). Эти методы основаны на принципе специфического взаимодействия антигена со специфическими антителами, но антитела здесь применяются меченые, т.е. предварительно окрашенные флюорохромом. Эти методы являются по своей сущности разновидностью серологических реакций, но ставятся они на предметном стекле (в мазке).
В настоящее время налажено производство флюоресцирующих сывороток и гаммаглобулинов централизованным путем. Выпускаются они в сухом виде в ампулах с приложением на каждую упаковку инструкции по применению и с указанием титра сывороток.
МФА можно разделить на две разновидности: 1) прямой метод; 2) непрямые методы - а) с использованием антивидовой флюоресцирующей сыворотки и б) с использованием антикомплементарной флюоресцирующей сыворотки.
Прямой метод флюоресцирующих антител. Этот метод технически наиболее прост и более специфичен по результативности. Сущность метода заключается в том, что на предметное стекло фиксированным физическим или химическим способом на нем мазком, содержащим антиген, наносят небольшое количество (2-3 капли) меченой сыворотки или глобулинов в рабочем титре и выдерживают во влажной камере в термостате 30-40 мин, а затем мазок промывают каким-либо буферным раствором и дистиллированной водой (можно только дистиллированной водой). Высушивают мазки на воздухе или в термостате и просматривают под иммерсионной системой (рис. 69). Если антиген и антитела специфичны, то на темном фоне будет отчетливо видно салатово-зеленое свечение антител, адсорбировавшихся на антигенах. Если же антитела были неспецифичны антигену (или антигена в мазке не было), то свечение отсутствует, так как антитела удаляются с препарата при промывании водой. К недостаткам прямого метода следует отнести то, что при этом в лаборатории нужно иметь на каждый возбудитель специфическую флюоресцирующую сыворотку (или глобулин), а они сравнительно дорогие и имеют небольшой срок хранения.
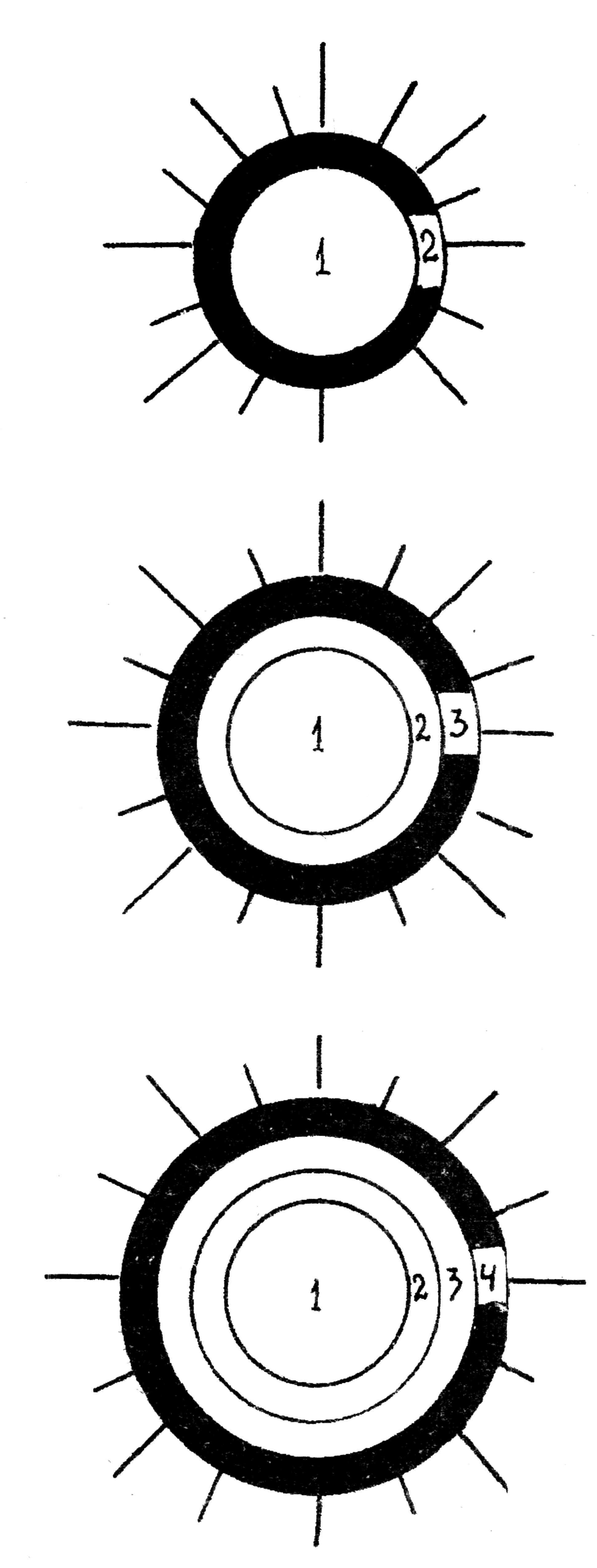
Рис. 69. Схема прямого и непрямого методов флюоресцирующих антител (реакция иммунофлюоресценции)
А. Прямой метод
1. Исследуемый антиген (мазок)
2. Меченые специфическая сыворотка или -глобулин
Б. Непрямые методы
1. Исследуемый антиген (мазок)
2. Немеченые специфическая сыворотка или -глобулин
3. Меченая антивидовая сыворотка.
1. Исследуемый антиген (мазок)
2. Немеченые специфическая сыворотка или -глобулин
3. Комплемент
4. Меченая антикомплементарная сыворотка
Непрямые методы флюоресцирующих антител. Называются они так потому, что флюоресцирующая сыворотка (антитело) при этих методах адсорбируется не на антигене, а на посредника (на специфическое неокрашенное антитело или на комплемент, которые являются для флюоресцирующих антител антигеном).
Непрямой метод с использованием антивидовой флюоресцирующей сыворотки. Сущность и техника этого метода заключается в том, что на фиксированный мазок сначала наносят специфическую для предполагаемого в мазке антигена не меченую иммунную сыворотку или глобулин и выдерживают во влажной камере при 37°С 30-40 мин. Затем мазок осторожно промывают фосфатным буфером или просто дистиллированной водой. Если в мазке имеется антиген, то образуется комплекс «антиген-антитело», который при промывании мазка не смывается. Однако полученный комплекс невидим, чтобы его обнаружить в люминесцентном микроскопе, мазок дополнительно обрабатывают флюоресцирующей антивидовой сывороткой или глобулинами. Антивидовые сыворотки или глобулины получают путем гипериммунизации кролика (или другие виды животных) сывороткой или глобулинами того вида животных, от которых получают специфическую вирусному антигену гипериммунную неспецифическую сыворотку. Для этого на мазок наносят антивидовую флюоресцирующую сыворотку и снова контактируют во влажной камере при 36-37°С 30-40 мин. Затем мазок промывают и высушивают на воздухе. В результате антивидовая сыворотка адсорбируется на комплекс «антиген+антитело» и, поскольку антивидовая сыворотка или глобулины меченые, образовавшийся комплекс «антиген+антитело+антивидовое антитело» светится салатово-зеленоватым цветом.
Если же в первой стадии компоненты были неспецифичны или в мазке было мало антигена, комплекс «антиген+антитело» не образуется, и антивидовые антитела не свяжутся, при промывании мазка смоются с него и поэтому свечения не будет.
Непрямой метод с использованием антикомплементарной флюоресцирующей сыворотки по своей сущности и технике является разновидностью РСК, но ставится на предметном стекле, и роль гемолитической системы выполняет флюоресцирующая антикомплементарная сыворотка.
Для подтверждения специфичности результатов РИФ необходимы следующие контроли. Для прямого варианта проводят окраску гомогенных и гетерогенных в антигенном отношении микроорганизмов люминесцирующей сывороткой. Свечение бактерий должно быть в первом случае и отсутствовать во втором.
Для непрямого метода мазки, содержащие гомологичные и гете-рологичные в антигенном отношении микроорганизмы, обрабатывают люминесцирующей сывороткой. Бактериальные клетки не должны светиться. Мазки с гомологичными и гетерологичными бактериями обрабатывают иммунной (антимикробной) сывороткой (1-й этап) с последующим нанесением флюоресцирующей антиглобулиновой сыворотки (2-й этап). Специфическое свечение бактерий должно быть в первом случае и отсутствовать во втором».
Интенсивность свечения оценивается по четырехбальной системе: ++++ - очень яркая флюоресценция по периферии микробной клетки; +++ - яркая флюоресценция периферии клетки; ++ - слабое свечение периферии клетки; + - нет контрастного свечения периферии и тела микробной клетки. Реакцию иммунофлюоресценции засчитывают, если специфическое свечение микробных клеток на четыре или на три плюса.
Задания для самостоятельной работы
1. Готовые и фиксированные мазки, приготовленные из бактериальной культуры или патологического материала, обработать ее специфической меченой сывороткой, согласно методическим указаниям.
2. Провести микроскопию препаратов под иммерсионной системой люминесцентного микроскопа или осветителя. Микрокартину зарисовать.
Вопросы для самоподготовки знаний
1. В чем заключается сущность люминесценции и принцип люминесцентной микроскопии?
2. Дать понятие методу флюорохромирования и его использование при диагностике инфекционных болезней.
3. Сущность метода флюоресцирующих антител и его вариантов.
4. Значение реакции иммунофлюоресценции (РИФ) при диагностике инфекционных болезней.
Таблица 18
Схема обработки мазка флюоресцирующими сыворотками
|
Прямой метод |
||
|
1 |
2 |
3 |
|
Изготовление, сушка, фиксация |
Нанесение флюоресцирующей сыворотки на мазок (3-15 мин во влажной камере при 37°С) |
Отмывка сыворотки физ. раствором (5-10 мин) |
Таблица 19
|
Непрямой метод |
||||
|
1 |
2 |
3 |
4 |
5 |
|
Изготовление, сушка, фиксация |
Нанесение специфической сыворотки на мазок (3-15 мин) |
Отмывка сыворотки физ. раствором (5-10 мин) |
Нанесение специфической меченой сыворотки на мазок (3-15 мин) во влажной камере |
Отмывка сыворотки физ. раствором |