ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1167
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Тема 12. Исследование бактерий на подвижность
ЦЕЛЬ ЗАНЯТИЯ. Освоить и овладеть методами исследования бактерий на подвижность.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ. Выделенные чистые культуры бактерий на МПБ. Обычные предметные стекла и с лунками, вазелин. Таблицы, схемы, рисунки.
Выделив чистую культуру на жидкой питательной среде, определяют подвижность этих бактерий.
Подвижность или ее отсутствие у бактерий является одним из многих признаков для определения их вида.
Органами движения у некоторых видов бактерий являются жгутики. Они состоят из белковых веществ, отличающихся от белков тела клетки. Жгутики – очень тонкие образования, диаметр их 0,02-0,05 мкм. Они во много раз длиннее бактерий.
Передвижение бактерий связано со спиралевидными движениями жгутиков.
Рассмотреть жгутики у бактерий под обычным световым микроскопом невозможно, так как их малые размеры лежат за пределами разрешающей способности микроскопа. Обнаруживают жгутики у бактерий различными способами. Строение их и другие детали изучаются методом электронной и фазово-контрастной микроскопии. Расположение и количество жгутиков можно рассмотреть под световым микроскопом, применяя «сверхокраску» по методу Леффлера. Сложность и недоступность этих методов исключает их использование в условиях практических лабораторий. По расположению жгутиков подвижные микробы условно разделяют на 3 группы.
1. Монотрихи – бактерии с одним жгутиком на конце.
2. Лофотрихи – бактерии с пучком жгутиков на одном конце.
3. Перитрихи – бактерии со жгутиками по всей поверхности тела (рис. 33).
Практически изучение микробов в живом состоянии применяется для определения подвижности, то есть косвенного подтверждения наличия жгутиков. Движение микробов можно наблюдать в препаратах «раздавленная капля» или «висячая капля». Микроскопируют эти препараты сухим или иммерсионным объективом. Лучшие результаты получают при микроскопировании в темном поле зрения.
Метод «раздавленной» капли. На середину предметного стекла наносят каплю исследуемого материала. Каплю накрывают покровным стеклом так, чтобы не появились пузырьки воздуха; жидкость должна заполнять все пространство и не выступать за края стекла.
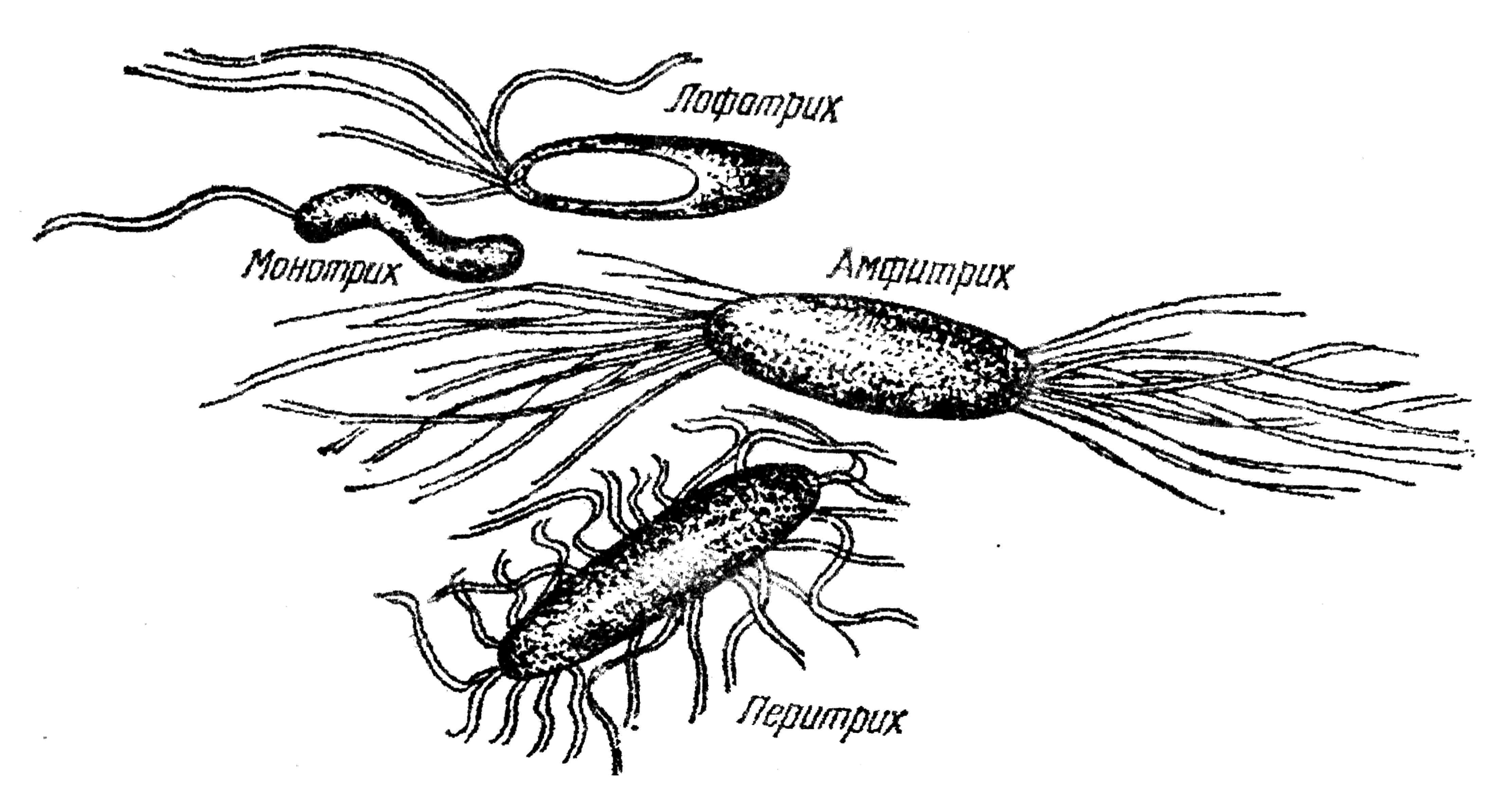
Рис. 33. Расположение жгутиков у бактерий
Недостатком метода «раздавленной» капли является быстрое высыхание препарата. При длительном микроскопировании препарата рекомендуют смазывать края покровного стекла вазелином. Кроме того, можно использовать метод «висячей» капли.
Метод «висячей» капли. Для приготовления этого препарата используют специальные предметные стекла с углублением («лункой») в центре. Небольшую каплю исследуемого материала наносят на середину покровного стекла, края лунки предварительно смазывают вазелином. Предметное стекло накладывают на покровное так, чтобы капля находилась в центре лунки. Затем его осторожно переворачивают, чтобы капля свисала в центре герметично закрытой полости лунки. В такой замкнутой полости капля защищена от высыхания (рис. 34).
При микроскопии таких препаратов в проходящем свете для получения большей контрастности слегка затемняют поле зрения; конденсор при этом опускают, поступление света регулируют вогнутым зеркалом. Вначале пользуются малым увеличением (объектив х8), после того как обнаружат край капли, устанавливают объектив х40 или иммерсионный.
При недостаточном опыте иногда ошибочно принимают пассивное молекулярное (броуновское) движение за истинное – активное. Следует учитывать, что при активном движении с помощью жгутиков бактерии могут пересекать все поле зрения и совершать круговые движения.
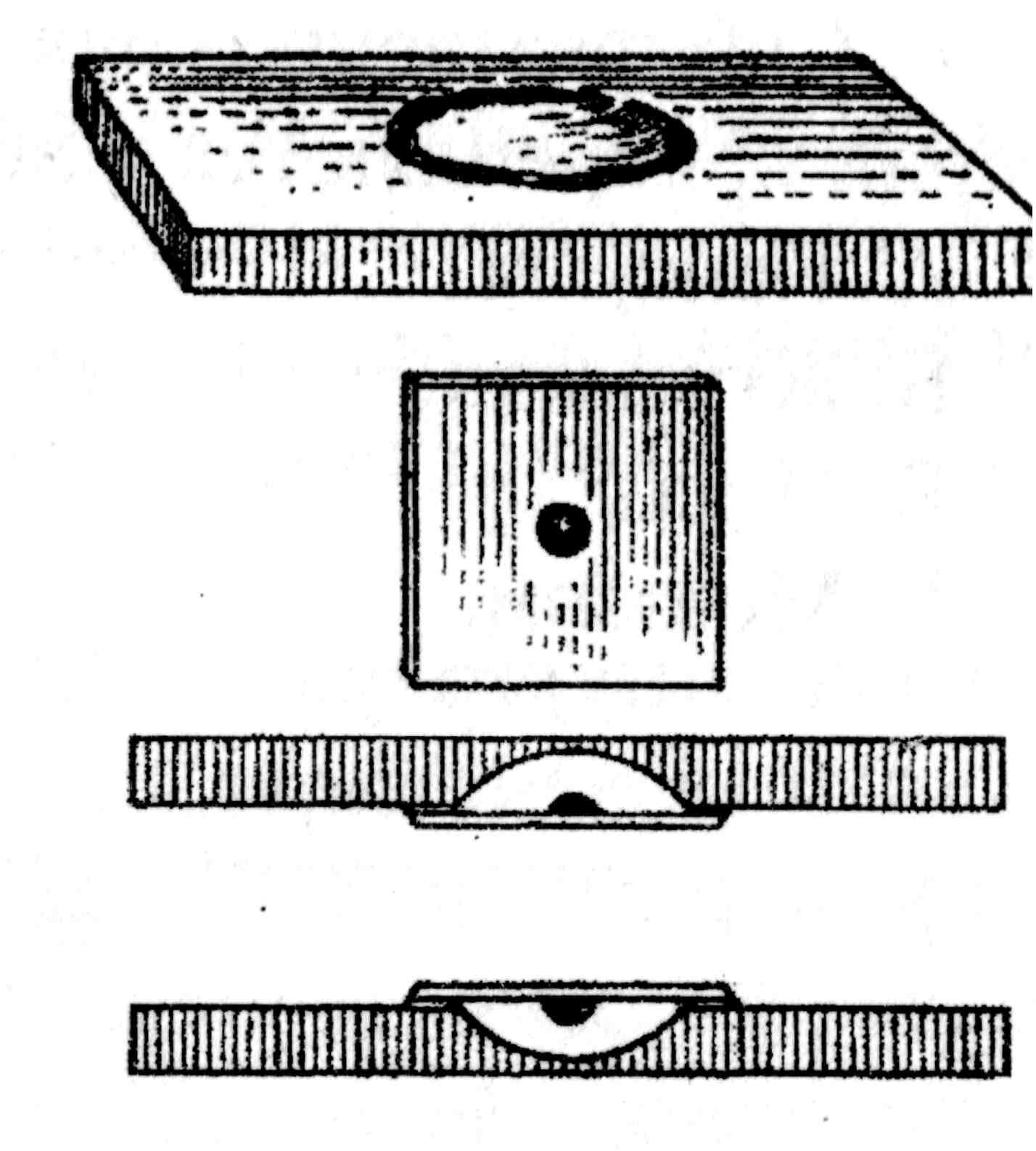
Рис. 34. Препарат «висячая» капля для исследования бактерий на подвижность
Задания для самостоятельной работы
1. Приготовить препараты «раздавленная» и «висячая» капли из чистых культур бактерий из МПБ.
2. Провести микроскопию приготовленных препаратов с целью установления подвижности бактерий. Полученные результаты внести в бланк экспертизы.
Вопросы для самоподготовки и контроля знаний
1. 1. Бактерии, имеющие пучок жгутиков на одном из полюсов клетки.
2. Бактерии, имеющие один жгутик.
3. Бактерии, имеющие жгутики на всей поверхности клетки.
А. Перитрихи.
Б. Монотрихи.
В. Лофотрихи.
2. Бактерии, имеющие жгутики (подвижные):
А. Сальмонеллы.
Б. Кишечная палочка.
В. Стафилококки.
Г. Сибиреязвенная палочка.
3. Бактерии прикрепляются к поверхности клеток при помощи:
А. Капсулы.
Б. Жгутиков.
В. Пили.
Г. Мезосом.
В. Биологические методы исследований
Тема 13. Методы заражения лабораторных животных (13.1). Определение вирулентности микроорганизмов (13.2). Бактериологическое исследование трупа животного (13.3)
ЦЕЛЬ ЗАНЯТИЯ. Изучить и освоить методы заражения лабораторных животных, способы определения вирулентности микроорганизмов, овладеть методикой бактериологического исследования трупа.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Лабораторные животные: белые мыши, морские свинки, кролики. Стерильные шприцы, иглы в стерилизаторах, стерильные тампоны, 70° этиловый спирт. Краски для мечения животных. Стерильный физиологический раствор. Доски для фиксации трупов в кюветах. Комплект инструментов для вскрытия животных. Дезрастворы: 5%-ный раствор карболовой кислоты или 3%-ный раствор лизола. МПБ и скошенный МПА, бактериологические петли, стерильные пастеровские пипетки. Предметные стекла, набор красок для окрашивания мазков-отпечатков.
13.1. Методы заражения лабораторных животных
Экспериментальное заражение лабораторных животных производится с целью:
- выделения из исследуемого материала чистой культуры возбудителя болезни,
- определения вида бактерий при диагностике болезни, т.е. идентификации;
- определения вирулентности;
- испытания на эффективность вакцин и лечебных сывороток.
Заражение животных с целью выделения чистой культуры патогенного микроорганизма, вызвавшего заболевание, производят в том случае, если в исследуемом материале содержится посторонняя микрофлора, которая на питательных средах подавляет рост возбудителя. Например, при исследовании несвежего патологического материала или объектов внешней среды на наличие возбудителей сибирской язвы заражают белых мышей или морских свинок.
У зараженных животных возникает септицемия – размножение микробов в крови. Зараженные животные погибают через 1-3 суток. Чистая культура возбудителя выделяется путем посева на питательные среды крови из сердца и внутренних органов.
Заражение животных производится также для исследования материала, содержащего незначительное количество микробов или их фильтрующие формы, которые не удается выделить при культивировании на питательных средах. Так, например, если при микроскопическом исследовании мокроты или осадка мочи не удается обнаружить микобактерии туберкулеза, этим материалом заражают морскую свинку. У экспериментального животного через 4-6 недель развивается генерализованный инфекционный процесс. При вскрытии во всех внутренних органах обнаруживают туберкулы (бугорки), при микроскопическом исследовании которых выделяют большое количество туберкулезных микобактерии.
Экспериментальное заражение производят при изучении заболеваний, вызванных вирусами и риккетсиями, в тех случаях, когда возбудители не могут быть обнаружены другими путями. Воспроизведение типичного заболевания у животного подтверждает присутствие вируса в исследуемом материале.
Кроме того, заражение животных применяют для определения вирулентности микробов, выделенных из исследуемого материала.
В микробиологической работе используют животных также с целью получения иммунных сывороток и вакцин, изучения их эффективности и безвредности (контроль биологических препаратов), взятия крови, необходимой для проведения различных реакций, и приготовления специальных питательных сред.
Для экспериментального заражения могут служить многие виды животных, но чаще используют белых мышей, морских свинок, хомяков, кроликов, реже голубей, кур, котят и др. Эти животные восприимчивы ко многим инфекционным болезням человека и животных, удобны в обращении и легко размножаются в вивариях.
С целью получения иммунных сывороток используют лошадей, кроликов, баранов, ослов; для приготовления вакцин против оспы, бешенства – телят, кроликов, белых мышей; контроль биологических препаратов производится на кроликах, морских свинках, белых мышах; кровь для приготовления питательных сред берут у баранов, кроликов.
При экспериментальном заражении животных изучаемый материал вводят различными путями: накожно, подкожно, внутрикожно, внутримышечно, внутривенно, внутрибрюшинно, в головной мозг и др.
Подготовка животных к заражению складывается из следующих этапов.
1. Отбор животных. Опыты проводят только на здоровых животных, которые отличаются гладкой блестящей шерстью, опрятны, активно двигаются и хорошо поедают корм. Кроме внешнего осмотра, перед заражением производят термометрию. У кроликов и морских свинок измеряют температуру ртутным термометром, изогнутым под углом. Термометр вводят в прямую кишку. Нередко температура измеряется не только до заражения, но и в течение всего опыта. Нормальная температура у лабораторных животных колеблется в следующих пределах: у морских свинок – 38-39°, у кроликов – 38,5-39,5°, у мышей – 37-39°.
2.Мелких животных метят, окрашивая анилиновыми красками или насыщенным раствором пикриновой кислоты. В протоколе отмечают место окраски. Более крупным животным (морские свинки и кролики) к ушам прикрепляют бирки с номерами.