ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1135
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Денатурация ДНК после фореза
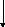 ДНК
иммобилизована в нитроцеллюлозном
фильтре
ДНК
иммобилизована в нитроцеллюлозном
фильтре
Сухая фильтровальная бумага
Рис. 72, А. Схема метода блоттинга по Саузерну:
а) расщепление ДНК-генома с помощью рестриктаз на куски по 15-20 тыс. пар нуклеотидов, электрофоретическое разделение этих рестриктаз в агарозном геле, перенос их на нироцеллюлозный фильтр, гибридизация ДНК-зондом и выявление образующихся гибридных молекул методом авторадиографии.
б) схема переноса блоттинга
Б 1 2 3
-
●
А
B
C
●
●
Рис. 72, Б. Дот-гибридизация ДНК-зонда М. bovis:
А: 1- М. bovis: 2, 3 – ДНК из пораженной туберкулезом ткани;
В: 1, 2, 3 – ДНК, выделенная из тканей здоровых животных;
С: 1 – ДНК возбудителя бруцеллеза;
2 – ДНК возбудителя листерий;
3 – ДНК M. fortuitum
Как видно из рисунка, положительные результаты (образование гибридных молекул ДНК) получены с ДНК М. bovis и с ДНК из пораженной туберкулезом ткани (А-2, А-3).
Отрицательные результаты получены с ДНК, выделенной из тканей здоровых животных (В-1, В-2, В-3), а также из возбудителя бруцеллеза (С-1), возбудителя листерий (С-2), из М. fortuitum (С-3).
Методика постановки ДНК-ДНК-гибридизации по индикации возбудителя бруцеллеза
Подготовка проб исследуемого материала:
1. Берут небольшие кусочки (0,3-0,2 г) органов, тканей, гомогенизируют их путем растирания с кварцевым песком и добавлением физиологического раствора.
2. Лизис клеток проводят с добавлением 10%-го водного раствора додецилсульфата, доводя его концентрацию до 0,5-1,0 % и проназу до 500 мкг/мл. Смесь инкубируют при 37°С 30 мин.
3. Добавляют равный объем смеси хлороформ-изоамилового спирта, энергично встряхивают и центрифугируют при 10 тыс. об/мин. Верхнюю водную фазу осторожно переносят в другую пробирку и добавляют 2,5 объема холодного 96° этанола. При этом ДНК выпадает в осадок.
4. Осажденную ДНК подсушивают на воздухе и растворяют в 10-20 мкл воды.
5. Берут капроновый фильтр, расчерчивают на квадраты со сторонами 1,5 х 1,5 см и на них в несколько приемов наносят растворенный осадок, предварительно подогретый до 100°С.
6. Фильтры подсушивают и выдерживают 2 часа под вакуумом при 80°С.
Фильтры с зафиксированными на них образцами можно долго хранить при комнатной температуре в вакууме.
Приготовление ДНК-зондов
1. Из бруцелл выделяют ДНК и озвучивают ее ультразвуком при 22 кГц в течение 1 минуты.
2. Полученные фрагменты ДНК метят радиоактивным фосфором методом трансляции. Дня этого радиоактивный трифосфат (ТТР) в количестве 60 мк-Кюри выпаривают под вакуумом при комнатной температуре. В эту же пробирку добавляют 5 мкл (5 мкг) озвученной ДПК, по 2 мкл всех остальных трех немеченых трифосфатов, 4 мкл 10хник-буфера, 2 мкл ДНК-полимеразы 1 и 2 мкл 10000 раз разведенной ДНК-азы. Все это перемешивают и ставят на 2 часа при 15С. Очистку зонда от невключившихся трифосфатов производят на колонке с сефадексом Ж-50. После этого этапа зонд готов для дальнейшей работы.
3. Капроновые фильтры с исследуемой ДНК запаивают в полиэтиленовые пакеты, оставив отверстие для внесения предгибридизационной смеси.
Состав предгибридизационной смеси:
Формамид 1,0 мл, 20хССЦ (ЗМ, 0,ЗМ цитрат натрия) - 1,2 мл 100х смеси Денхарда (1х-20го раствора фикола, 2%-ный поливинилпирролидина, 2%-го бычьего сывороточного альбумина) - 0,6 мл, ДНК из спермы лосося - 0,14 мл.
ДНК из спермы лосося предварительно денатурируется кипячением при 100°С в течение 5 мин. В пакет с фильтром вносят предгибридизационную смесь из расчета 0,5 мл на 1 см2 фильтра и инкубируют при 46°С 2 часа.
4. Предгибридизационную смесь выливают и в пакет вносят гиб-ридизационную смесь, состоящую из раствора, указанного в пункте 3, а также денатурированную ДНК из спермы лосося, ДНК-зонд. Смесь инкубируют при 46°С 16-20 часов (оставляют на ночь).
5. Гибридизационную смесь выливают и отмывание фильтров проводят в следующем режиме: в растворе состава 2хССЦ - 0,1 % ДДС 2 раза по 15 мин при комнатной температуре, в таком же растворе при 60°С по 15 мин 2 раза. В конце фильтры ополаскивают в 0,1хССЦ 2 раза и высушивают при комнатной температуре.
6. Для учета реакции проводят радиоавтографию или радиоактивность определяют на счетчике.
7. Радиоавтографию проводят в следующем порядке: в рентгеновскую кассету (на экран) лейкопластырем приклеивают лист обычной бумаги, на него крепят фильтр после гибридизации и на последнюю накладывают в темноте рентген-пленку. Рентген-кассету закрывают, помещают в полиэтиленовый пакет и оставляют на ночь при –70°С или –20°С. После холодильника кассету выдерживают в течение 1 часа при комнатной температуре, затем в темноте вынимают пленку, проявляют и изображение закрепляют.
При наличии бруцелл в тканях в тех квадратах фильтра, куда они были нанесены, на пленке появляются черные пятна.
После установления бруцелл в исследуемых пробах необходимо определение видовой принадлежности бруцелл, которое проводится методом мультилокусной геномной дактилоскопии.
Задание для самостоятельной работы
1. Ознакомиться с оборудованием, аппаратурой, компонентами для проведения реакции ДНК-зондов.
2. Провести фрагментально постановку реакции ДНК-зондов.
Вопросы для самоподготовки и контроля знаний
1. Сущность и принципы проведения ДНК-зондов.
2. Компоненты и методика проведения блоттинга по Саузерну.
3. В чем заключается метод генной дактилоскопии?
4. Методика постановки ДНК-ДНК гибридизации по индикации возбудителя бруцеллеза.
Раздел IV. Специальная (частная) микробиология
Частная микробиология изучает отдельные патогенные микроорганизмы, вызывающие инфекционные болезни животных.
При составлении этого раздела авторы придерживались изложения материала в следующей последовательности.
Классификация.
Общая характеристика болезни.
Восприимчивые животные.
Патогенез и факторы вирулентности.
Методы диагностики:
А. Бактериологический метод.
1. Материал для исследования.
2. Микроскопия.
3. Культивирование.
4. Биопроба.
Б. Серологическая диагностика.
В. Аллергическая диагностика.
5. Биопрепараты для специфической профилактики.
6. Биопрепараты для специфической терапии.
Для достижения большей эффективности самоподготовки каждая тема должна завершаться контролем знаний по тестовым вопросам, которые представлены в конце этого раздела.
Тема 28. Патогенные стафилококки.
ЦЕЛЬ ЗАНЯТИЯ. Изучить свойства возбудителей и методы бактериологической диагностики болезней, вызванных патогенными стафилококками.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ. Для демонстрации необходима таблица-схема бактериологического исследования при стафилококкозах. Патологический материал (гной, пробы молока от коров, больных маститом), питательные среды: МПБ, МПА, селективная среда – солевой кровяной МПА, глюкозо-сывороточный МПБ; пастеровские пипетки, чистые культуры стафилококка.
При подготовке к занятию необходимо уяснить следующие вопросы:
Виды патогенных кокков и вызываемые ими заболевания.
Морфологические и культуральные особенности патогенных стафилококков.
Общая схема бактериологической диагностики заболеваний, вызываемых патогенными стафилококками.
1. Классификация сем. Micrococcaceae
Род: Staphylococcus
Виды: S. aureus – наиболее патогенный,
S. epidermidis – наименее патогенный,
S. saprophyticus – очень редко вызывает болезни.
2. Общая характеристика болезни
– вызывает гнойно-воспалительные процессы различной локализации: местные – фурункулы, абсцессы и др.; общее поражение – пиемия и септицемия.
– пищевые токсикозы (токсикоинфекции).
3. Восприимчивые животные
– все виды, включая человека и птиц.
4. Патогенез и факторы вирулентности
– проникает в организм через поврежденную кожу и слизистые оболочки;
– энтеротоксины – с пищевыми продуктами (мясо, молоко и др.);
– образуют и выделяют экзотоксины: гематоксин, лейкоцидин, энтеротоксин, некротоксин;
– образуют и выделяют ферменты: коагулазу, фибринолизин, гиалуронидазу, ДНК-азу.
Методы диагностики (рис. 73):

Рис. 73. Схема лабораторной диагностики стафилококкозов.
А. Бактериологический метод
1. Материал для исследования:
– раневой экссудат, гной абсцессов, ран, молоко при маститах, выделение из половых органов при эндометритах, кровь при септицемии;
– пищевые продукты, рвотные массы при отравлениях.
2. Микроскопия
а) методы окраски: простой метод и по Граму.
б) микрокартина: шаровидные клетки располагаются беспорядочно, диаметр 0,5 – 1,5 мкм (рис.74).
в) грамположительные.
г) спор не образуют.
д) капсулу не образуют.
е) неподвижны.
(Можно обозначить и по формуле: Гр+, СН–, Кп–, Пд–)
3. Культивирование
а) посев на питательные среды: МПА, МПБ, МПА с 15% хлорида натрия, кровяной МПА.
б) особенности выделения чистой культуры:
– факультативные анаэробы
– оптимальная температура 37С,
– срок культивирования 18-20 ч.
в) культуральные свойства:
– на МПА – колонии округлые, диаметром 2-5 мм, с ровным краем, могут быть окрашены в золотистый цвет (S. aureus), белый (S. epidermidis), лимонно-желтый (S. saprophyticus)
– на жидких средах: на МПБ – равномерное помутнение с выпадением рыхлого хлопьевидного осадка.
г) биохимические свойства (ферментативная активность)
для патогенных стафилококков характерны:
– ферментация маннита без газа (в анаэробных условиях),
– гемолиз на кровяных средах (рис. 75),
– ДНК-азная активность (рис. 76)
– рост на элективных средах,
– плазмокоагуляция.
4. Биопроба для определения свойств: