ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1183
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Продолжительность реакции определяется числом циклов, необходимых для синтеза ДНК-амплификата в количестве, достаточном для дальнейшего исследования или индикации. Индикация производится с помощью электрофореза или с помощью меченого ДНК-зонда.
Методика постановки полимеразной реакции
1. Получение ДНК-образца (лизатов, исследуемого материала). Для этого исследуемый материал суспензируют в буфере или дистиллированной воде, добавляют 1 М раствор NаОН и выдерживают при 37°С 6-7 мин. Смесь нейтрализуют добавлением трис-(оксицетил)аминометана (рН=6,0). Лизат центрифугируют при 5000 об/мин 10 мин для осаждения крупных частиц. Надосадочную жидкость, содержащую ДНК и РНК, используют для постановки ПЦР.
2. Проведение полимеразной цепной реакции – амплификация данного фрагмента (ДНК-гена). Для этого вносят буферный раствор (буфер для ПЦР (10х)-500 mM КСl, 100 mМ трис-НСl рН – 8, 14, 15 mМ МgС1, 0,1 % желатина или бычьего сывороточного альбумина), фермент ДНК-полимеразу, праймер – олигонуклеотид-затравку, трифосфаты – предшественники синтеза ДНК, исследуемый образец ДНК или биологическая жидкость – кровь, моча, слюна, мокрота и т.д.
3. В пробирку емкостью 1,5 мл (эппендорф) собирают смесь, состоящую из:
125 мкл бидистиллированной стерильной воды,
15 мкл буфера для ПЦР,
5 мкл раствора трифосфатов,
3 мкл раствора праймера,
3 мкл раствора ДНК-полимеразы термостойкой.
Смесь разливают в 5 пробирок (емкостью 0,5 мл) по 30 мкл. В каждую из них вносят по 0,5-1,0 мкл надосадочной жидкости из лизата, перемешивают, сверху наслаивают по 25 мкл стерильного вазелинового масла. Включают амплификатор и устанавливают режим работы:
плавления - 92°С в течение 60 с;
отжиг ДНК - 55°С в течение 60 с;
синтез ДНК - 70°С в течение 75 с.
В стадии плавления пробирки устанавливают в амплификатор; проводят 80 циклов амплификации, что занимает 3 часа времени, и за этот срок из одной молекулы ДНК образуется до 1 млн молекул-копий. Реакцию останавливают на стадии «синтеза» и в этой стадии выдерживают 3-5 мин для окончательного досинтезирования фрагментов ДНК.
Полученные пробы молекул ДНК подвергают электрофорезу в агарозном геле. Для этого готовят 1,7%-ный раствор агарозы с этидий бромидом (краситель), разливают на подложку и устанавливают пластинку с зубцами для образования лунок. Через 10-15 мин агароза полимеризуется (застывает).
Пластинку с зубцами осторожно снимают, при этом на агарозе образуются лунки. В аппарат для электрофореза заливают буфер и устанавливают электроды.
В полученные в агарозе лунки вносят пробы:
1) амплификат;
2) праймер (свидетель);
3) лизат, полученный из исследуемого материала.
Электрофорез проводят в режиме 4-5 V/см. Через 40-50 мин аппарат отключают, вынимают пластинку с агарозой и 10 мин окрашивают в 1,7%-ном растворе этидия бромида. Агарозную пластинку помещают на трансиллюминатор, освещают ультрафиолетовыми лучами и фотографируют.
Полосы в агарозной пластинке, выявляемые при ультрафиолетовом освещении, являются фрагментами ДНК, синтезированные в процессе амплификации со специфическим для каждого возбудителя праймером.
На электрофореграмме выявляют расположение полос, которое зависит от электрофоретической подвижности компонентов реакции. Положительной реакцией считают расположение полос на электрофореграмме на одном и том же уровне, что указывает на идентичность амплификанта и праймера. При отрицательных пробах и контроле совпадение полос не происходит или они отсутствуют.
Задание для самостоятельной работы
1. Ознакомиться с оборудованием, приборами, компонентами, реактивами, используемыми для постановки ПЦР.
2. Провести фрагментально постановку ПЦР.
Вопросы для самоподготовки и контроля знаний
1. Охарактеризуйте структуру ДНК.
2. В чем сущность принципа комплементарности ДНК?
3. Преимущества ПЦР при диагностике инфекционных болезней по сравнению с другими методами.
Тема 27. Использование в микробиологии днк-зондов
ЦЕЛЬ ЗАНЯТИЯ. Освоить сущность реакции гибридизации нуклеиновых кислот (ДНК-зонды), ознакомиться с ее компонентами и методами постановки.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Набор компонентов, реактивов для постановки реакции ДНК-зондов.
Приборы и аппаратура: аппарат для горизонтального электрофореза, вакуум-шкаф с подогревом, счетчик радиоактивности, настольная центрифуга на 10 тыс. об/мин, рентгенкассета с усиливающими экранами.
Метод ДНК-зонды основан на уникальном свойстве генетического материала организма — молекулы ДНК, состоящей из мононуклеотидов, образовывать двойную спираль путем комплементарного соединения азотистых оснований. Молекула ДНК образует двойную спираль, при которой азотистые основания первой цепи строго комплементарно соединяются водородными связями с азотистыми основаниями второй цепи, где аденин соединяется с тимином, гуанин – с цитозином.
Принцип метода состоит в том, что структуру двойной спирали ДНК (или РНК) можно разрушить нагреванием и при этом происходит разделение цепей. Этот процесс называется денатурацией или плавлением ДНК. Температуру, при которой происходит разделение цепей ДНК, называют точкой плавления, которая равняется 85-95°С. Этот процесс обратимый, то есть при снижении температуры происходит восстановление связей – образование двойной спирали. Это явление называют ренатурацией. Если при ренатурации взяты молекулы из разных источников, говорят о гибридизации. Способность к гибридизации двух препаратов нуклеиновых кислот является строгим тестом на комплементарность их последовательностей.
Гибридизацию можно осуществлять в растворе или на фильтре (капроновом или нитроцеллюлозном). Удобным для работы является метод гибридизации с использованием фильтров. При этом один из препаратов ДНК иммобилизуют на нитроцеллюлозных фильтрах, на которых молекула ДНК адсорбируется. Затем погружают их в раствор, содержащий второй препарат денатурированной ДНК (ДНК-зонд). Связывание ДНК-зонда происходит только в том случае, если она имеет последовательность нуклеотидов, комплементарную первоначально адсорбированной на фильтре молекуле ДНК (рис. 71).
Эффективность гибридизации определяют по количеству метки, оставшейся на фильтре. Метод является очень чувствительным. При этом необходимо иметь меченные радиоактивным изотопом РНК или ДНК-зонды, идентификация которых с исследуемой молекулой регистрируется с помощью радиоавтографии.
В качестве ДНК-зонда используют меченые копии ДНК с известной последовательностью нуклеотидов.
Метод блоттинга по Саузерну
Для идентификации гена молекулу ДНК-генома расщепляют с помощью ферментов рестриктаз на куски размером примерно по 15-20 тыс. пар нуклеотидов.
Расщепленный таким образом геном подвергается электрофоре-тическому фракционированию в агарозном геле. После этого фракции ДНК денатурируют нагреванием и переносят из агарозного геля на нитроцеллюлозный фильтр, где их иммобилируют. Процесс переноса ДНК напоминает промокание (по английски – блоттинг) и называется методом блоттинга по Саузерну. Сущность блоттинга заключается в том, что агарозный гель помещают на фильтровальную бумагу, замоченную в концентрированном солевом растворе, затем на гель накладывают нитроцеллюлозный фильтр и сверху помещают сухую фильтровальную бумагу.
Солевой раствор впитывается в сухую бумагу, чтобы это произошло, он должен пройти сквозь агарозный гель и затем через нитроцеллюлозный фильтр. ДНК переносится вместе с раствором, но задерживается нитроцеллюлозой. Иммобилизованную таким образом ДНК можно гибридизировать на месте с радиоактивным зондом. Со специфичным зондом будут гибридизироваться только комплементарные ему фрагменты. Так как зонд радиоактивный, то гибридизацию можно обнаружить с помощью авторадиографии.
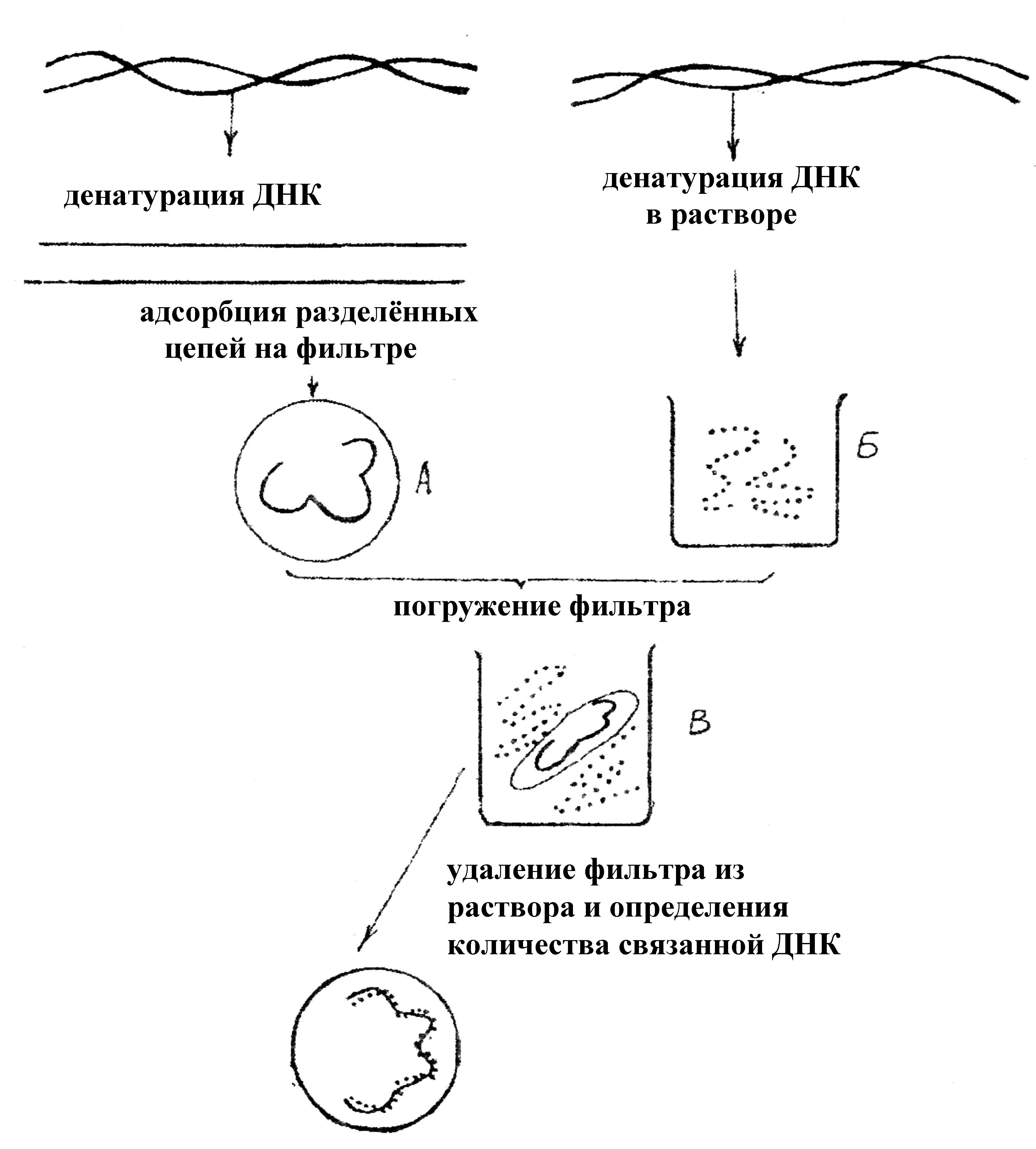
Рис. 71. Схема гибридизации на фильтре: А – иммобилизированная на фильтре одноцепочечная ДНК; Б – одноцепочечная ДНК в растворе; В – фильтр с иммобилизованной одноцепочечной ДНК опускается в раствор, содержащий денатурированную молекулу ДНК
Каждая комплементарная последовательность проявляется в виде радиоактивной полосы, месторасположение которой определяется размером фрагмента ДНК (рис. 72 А).
Метод блоттинга является высокочувствительным и широко применяется в различных областях, в том числе для диагностики инфекционных болезней сельскохозяйственных животных, например, для обнаружения возбудителей сибирской язвы, бруцеллеза, туберкулеза, ящура, чумы свиней, чумы птиц, энтеровирусов и т.д.
Генная дактилоскопия
Метод заключается в анализе гипервариабельных участков молекул ДНК, который включает следующие этапы: выделение ДНК, фрагментация ее с помощью электрофореза в геле. Фрагменты, содержащие гипервариабельные участки, выявляют с помощью специального зонда - «проба Джеффриса», с которой они связываются путем гибридизации, выявляемые авторадиографически.
В качестве радиоактивного зонда может быть использована ДНК, выделенная из бактериофага М-13.
Метод точечной (дот) гибридизации выполняется путем внесения исследуемых образцов ДНК в денатурированном состоянии на капроновые мембранные фильтры в виде точек. Например, ДНК микобактерий туберкулеза крупного рогатого скота в количестве 3 мкл (1,8 мкг/мл) в виде точек наносится в квадраты (1,5 х 1,5 см). Одноцепочечные молекулы ДНК (денатурированные) адсорбируются на мембране и фиксируются. После этого на фильтр наносится ДНК-зонд, одноцепочечная молекула ДНК, выделенная, например, из Myc. bovis, меченая радиоактивным фосфором.
В случае совпадения азотистые основания молекул ДНК M. bovis и меченная 32Р ДНК-зонда комплементарны, то происходит связывание азотистых оснований с образованием двойной спирали. После этого несвязанные молекулы ДНК-зонда отмываются и образующиеся гибридные молекулы выявляют радиоавтографически.
На рис. 72 Б представлены результаты исследования патологического материала на туберкулез.
А а) Расщепление ДНК-генома с помощью рестриктаз

электрофорез в агарозном геле

перенос (блоттинг) на нитроцеллюлозу

гибридизация с радиоактивным зондом
для обнаружения специфической последовательности

выявление гибридных молекул методом авторадиографии
 б)
Солевой раствор. Фильтровальная
бумага,
б)
Солевой раствор. Фильтровальная
бумага,
в




 ымоченная
в концентрированном солевом растворе
ымоченная
в концентрированном солевом растворе