ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1203
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
При выращивании аэробов и факультативных анаэробов аэрация происходит в естественных условиях без применения каких-либо дополнительных приспособлений.
Сроки культивирования большинства патогенных микроорганизмов составляют 18-24 часа, но есть и культуры, растущие медленно – до 4-6 недель.
8.3. Методы выделения чистых культур бактерий
Морфологические, культуральные и биохимические особенности микроорганизмов, необходимые для определения вида с целью постановки бактериологического диагноза, изучают, используя чистые культуры бактерий.
Микробы, выделенные из внешней среды, организма животных или людей и размноженные на питательных средах, называют культурами.
В исследуемом материале патогенные микроорганизмы во многих случаях находятся в числе других, чаще сапрофитных бактерий. Выделить чистую культуру возбудителя болезни является основной задачей при проведении бактериологической диагностики.
Чистая культура микробов содержит только один вид микроорганизмов, который определяется по совокупности его свойств. Культура микроорганизмов, выделенная из определенного источника (организм животного, воздух, почва и др.) получила название штамм.
Если выделенная бактериальная культура одного вида различается по некоторым признакам, то она называется – вариант.
Методы выделения микроорганизмов из исследуемого материала можно отнести к двум группам – механические и биологические.
А. Механические методы
Они основаны на механическом разъединении одной бактериальной клетки от другой с целью получения отдельных изолированных колоний на плотной питательной среде. После культивирования посевов в термостате из отдельной нужной колонии делается пересев на питательную среду, в которой вырастают чистые культуры бактерий.
1-й день исследования
Из исследуемого материала готовят мазки и окрашивают их по Граму. При микроскопии устанавливают наличие бактерий, их морфологические особенности и отношение к окраске по Граму.
Для получения изолированных колоний исследуемый материал высевают на поверхность плотной питательной среды в чашках Петри.
Агар в чашки разливают следующим образом: флакон со стерильной питательной средой помещают в водяную баню. После расплавления агара и его охлаждения до 42°С флакон берут в правую руку, левой рукой извлекают пробку, обжигают горлышко флакона, большим и указательным пальцами левой руки слегка приподнимают крышку чашки. Вводят горлышко флакона под крышку чашки (не касаясь краев), наливают 15-20 мл питательного агара, быстро выводят горлышко флакона и закрывают чашку крышкой. Края горлышка флакона подводят к пламени и закрывают его обожженой пробкой. Слегка покачивая круговыми движениями чашку, достигают равномерного распределения среды. Чашки оставляют на месте, пока среда не застынет, а затем их переносят в термостат, поворачивая вверх дном, снимают крышку и оставляют в таком виде на 15-20 минут для подсушивания.
Существует несколько методов посева материала для выделения чистой культуры бактерий. Посев на чашки штрихом производится при помощи петли, которой набирают небольшое количество исследуемого материала и, не вынимая петлю из пробирки, стряхивают излишнее его количество. Чашку с питательной средой помещают на столе вверх дном. Левой рукой берут дно чашки, держа ее почти вертикально, и густо заштриховывают петлей небольшой участок агара в верхней части чашки. Петлю следует держать свободно большим и указательным пальцами правой руки, ближе к концу петледержателя. Освободив таким образом петлю от излишнего материала, легкими движениями, не повреждая поверхности среды, наносят, отрывая друг от друга, параллельные штрихи на расстоянии около 0,5 см.
В отдельных случаях можно производить последовательный рассев материала, используя для этого несколько чашек с питательной средой. Набрав петлей материал, производят посев штрихами на первой чашке и той же петлей, не набирая материала, вновь наносят штрихи на вторую и третью чашки с питательным агаром. На первой чашке обычно получают рост в виде сплошных штрихов, на второй и, особенно на третьей бактерии развиваются в виде изолированных колоний (рис. 27).
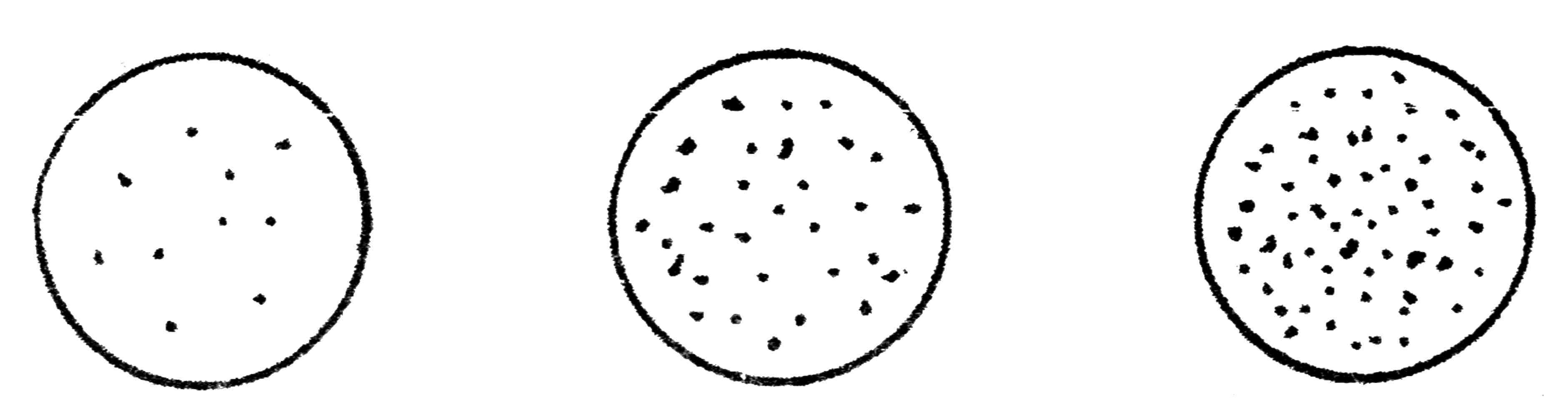
Рис. 27. Рост бактерий на плотной питательной среде при последовательном посеве
Посев шпателем. Посев исследуемого материала нередко производят шпателем, который заранее заворачивают в бумагу и стерилизуют горячим воздухом. Исследуемый материал в количестве одной петли или капли наносится пастеровской пипеткой в центр чашки со средой, каплю шпателем распределяют на небольшом участке среды, а затем круговыми движениями по всей ее поверхности. На время посева крышка чашки, поддерживаемая левой рукой, остается слегка открытой.
Шпатель из первой чашки быстро переносят во вторую чашку, а затем в третью. По окончании посева шпатель погружают в банку с дезинфицирующим раствором. Чашку с соответствующей надписью на дне помещают в термостат вверх дном для того, чтобы конденсационная вода, скапливающаяся на внутренней поверхности крышки, не попадала на поверхность посева и не размывала выросшие колонии.
2-й день исследования
Изучают культуральные свойства чистой культуры, выросшие колонии на третьей чашке. Их изучают невооруженным глазом, с помощью лупы, при малом увеличении микроскопа и иногда под стереоскопическим микроскопом.
Нужную колонию отмечают со стороны дна чашки восковым карандашом. Из нее делают мазок и окрашивают по Граму. При микроскопии изучают морфологические особенности и отношение бактерий к окраске по Граму. Из этой колонии делают пересев на питательные среды (МПА и МПБ). Посевы помещают в термостат для культивирования.
3-й день исследования
Изучают культуральные свойства бактерий на МПА и МПБ, делают мазок, окрашивают по Граму, микроскопируют. Убедившись в том, что бактериальная культура чистая, приступают к изучению ее биохимических (ферментативных) свойств, устанавливают подвижность, определяют чувствительность к антибиотикам и др.
В научно-исследовательской работе, особенно при генетических исследованиях, необходимо получать культуры заведомо из одной клетки. Такая культура называется клон. Для его получения чаще всего пользуются микроманипулятором. Этот прибор снабжен инструментами (иглами, пипетками) микроскопических размеров. С помощью держателя под контролем микроскопа их вводят в препарат с бактериями на предметном стекле и одну нужную клетку засевают в питательную среду.
Б. Биологические методы
Они основаны на учете тех или иных биологических особенностей выделяемых бактерий в чистую культуру.
1. Выделение спорообразующих микроорганизмов
При выделении чистых культур из исследуемого материала, содержащего споровые формы микробов, его прогревают 10 мин при 80° или 2-3 мин при 100° в расчете на то, что менее стойкие неспоровые формы погибнут при этой температуре. При этом споровые формы останутся жизнеспособными.
Из прогретого материала проводится посев на питательные среды, на которых вырастают спорообразующие микроорганизмы.
2. Выделение кислоустойчивых микроорганизмов.
Для выделения чистой культуры возбудителей туберкулеза и па-ратуберкулеза из патологического материала используют химический метод. С этой целью исследуемый материал после его гомогенизации обрабатывают 6%-ным раствором серной кислоты в течение 5-7 мин, добавляя ее в равном объеме. Благодаря этому погибают микробы сопутствующей микрофлоры, а кислотоустойчивые остаются жизнеспособными.
После нейтрализации раствора кислоты проводят посев на специальные питательные среды, на которых вырастают кислотоустойчивые микробы.
3. Выделение подвижных микроорганизмов (метод Шукевича)
Исследуемый материал, из которого выделяется подвижный микроб, засевают в конденсационную воду скошенного МПА. При посеве необходимо следить, чтобы петля с материалом не коснулась поверхности среды над конденсационной водой. Бактерии, обладающие активной подвижностью, вырастут не только в конденсационной воде, но и вне ее, на поверхности МПА. Из верхней части роста производят повторно посев в конденсат свежей питательной среды. Производя таким образом несколько пересевов, в конце концов получают чистую культуру подвижных бактерий.
4. Выделение патогенных микроорганизмов
Чистые культуры патогенных бактерий выделяют путем заражения исследуемым материалом лабораторных животных, наиболее восприимчивых к тому или иному возбудителю.
После гибели животного из крови и органов трупа делают посевы на питательные среды, на которых в большинстве случаев вырастает чистая культура возбудителя (этот метод подробно представлен в разделе «Заражение лабораторных животных»).
Задания для самостоятельной работы
1. Приготовить мазки-препараты из смеси бактерий, окрасить по Граму и провести микроскопию.
2. Овладеть техникой посева на скошенный МПА и МПБ.
3. Освоить методы и приемы выделения чистой культуры бактерий (1-й день исследования);
а) из смеси бактерий произвести рассев на солевой МПА для выделения чистой культуры стафилококка;
б) из смеси бактерий произвести рассев на среде Эндо для выделения чистой культуры кишечной палочки;
в) взвесь бактерий прогреть в течение 10 мин при 80° или 2-3 мин при 100°. Прогретую взвесь микробов рассеять на МПА для выделения чистой культуры вакцинного штамма сибиреязвенной палочки.
4. Посевы поместить в термостат и ознакомиться с его устройством.
5. Сведения о проделанной работе внести в бланк экспертизы.
Вопросы для самоподготовки и контроля знаний
1. Найдите каждому определению соответствующий термин:
1. Популяция микробов, состоящая из особей одного вида.
2. Культура микроорганизмов, полученная из одной особи (одноклеточная культура).
3. Культура микробов одного вида, выделенная из определенного источника (организм животного, окружающая среда).
4. Культура микроорганизмов одного вида, различающаяся по некоторым признакам (в пределах характеристики вида).
А. Клон. В. Вариант.
Б. Штамм. Г. Чистая культура.
2. В ветеринарную лабораторию поступил исследуемый материал после убоя животного с подозрением на туберкулез. Какой обработке необходимо подвергнуть материал перед посевом для выделения возбудителей туберкулеза?
А. Прогреть при 80° 2-3 мин.
Б. Обработать 6%-ным раствором серной кислоты в соотношении 1:6.
В. Засеять без обработки.
3. В ветеринарную лабораторию поступил несвежий патологический материал (кусочки мышц) после гибели коровы с подозрением на эмфизематозный карбункул. Какой обработке необходимо подвергнуть материал перед посевом для выделения возбудителя?
А. Прогреть при 80° 15-20 мин.
Б. Обработать 6%-ным раствором серной кислоты в соотношении 1:6.
В. Засеять без обработки.
4. В ветеринарную лабораторию на экспертизу поступили пробы мяса после вынужденного убоя животного. Необходимо исключить присутствие в них вульгарного протея, который может вызвать массовые отравления людей. Какой метод используете для выделения чистой культуры этого микроба?
А. Рассев на МПА в чашках Петри.
Б. Прогрев материала с последующим посевом на МПА.
В. Посев на МПБ.
Г. Посев на скошенный МПА в конденсат.
5. В ветеринарную лабораторию поступил исследуемый материал (ухо) от павшей нетели с подозрением на сибирскую язву. Какой метод используете для выделения чистой культуры возбудителя?
А. Посев на МПА и МПБ.
Б. Посев на среду Эндо.
В. Заражение лабораторного животного.
Г. Посев на скошенный агар в конденсат.