ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1160
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
3. Подготовка места введения материала. В месте введения шерсть удаляют выщипыванием, выстриганием, выбриванием или с помощью депилятория. Эту операцию производят накануне опыта, так как удаление шерсти любым способом вызывает раздражение кожи. В качестве депилятория очень часто используют смесь сернокислого бария и пшеничного крахмала, которые в равных количествах разводят водой до получения массы в виде густой сметаны. Накладывают эту массу на шерсть и через 3 мин удаляют ее вместе с шерстью, кожу тщательно промывают водой.
4. Животных фиксируют различными способами – в зависимости от вида животного и метода введения материала. Для этой цели используют специальные станки, доски-фиксаторы, ящики. В обычных условиях можно пользоваться более простыми приемами. Кроликов и морских свинок кладут спиной на стол, одной рукой держат за задние конечности, а другой обхватывают грудную клетку, вводя пальцы в подмышечные впадины.
Для взятия крови из сердца животных кладут на спину, растягивая в стороны и немного вверх передние конечности. Для внутривенных инъекций удобнее всего кролика завернуть в полотенце, тесно прижав конечности к туловищу.
Мышей берут за хвост левой рукой, опускают на стол, туловище быстро прижимают к столу двумя пальцами правой руки и, скользя по спине, как бы массируя ее к голове, захватывают кожу над головой, мышь слегка растягивают. Можно держать мышей одной рукой, тогда экспериментатор обходится без помощника.
Место инъекции дезинфицируется спиртом или йодной настойкой или промывают стерильным раствором поваренной соли.
Инструменты, необходимые для заражения животных (шприцы в разобранном виде, иглы, пинцеты), кипятят в течение 10-20 минут и более в зависимости от природы вводимого материала.
Подкожное введение материала. Двумя пальцами левой руки захватывают кожу, слегка меняют направление иглы, чтобы материал не выливался, затем вводят содержимое шприца, надавливая поршень левой рукой. По окончании введения иглу быстро извлекают, предварительно положив на нее вату, смоченную дезинфицирующим раствором. У кроликов и морских свинок подкожные инъекции удобно делать на спине и животе, у крыс и мышей – на спине, у корня хвоста. Доза введения не более 0,1 – 0,2 мм (рис. 35).

Рис. 35. Техника подкожного заражения
Внутрикожное введение применяется значительно реже. Кожу растягивают двумя пальцами левой руки или натягивают на палец, как перчатку. Иглу вводят под острым углом отверстием кверху в поверхностный слой эпидермиса так, чтобы конец иглы просвечивался. При введении жидкости появляется пузырек, который не исчезает в течение 5 минут. Внутрикожно вводят материал в объеме 0,1-0,2 мл (рис. 36).
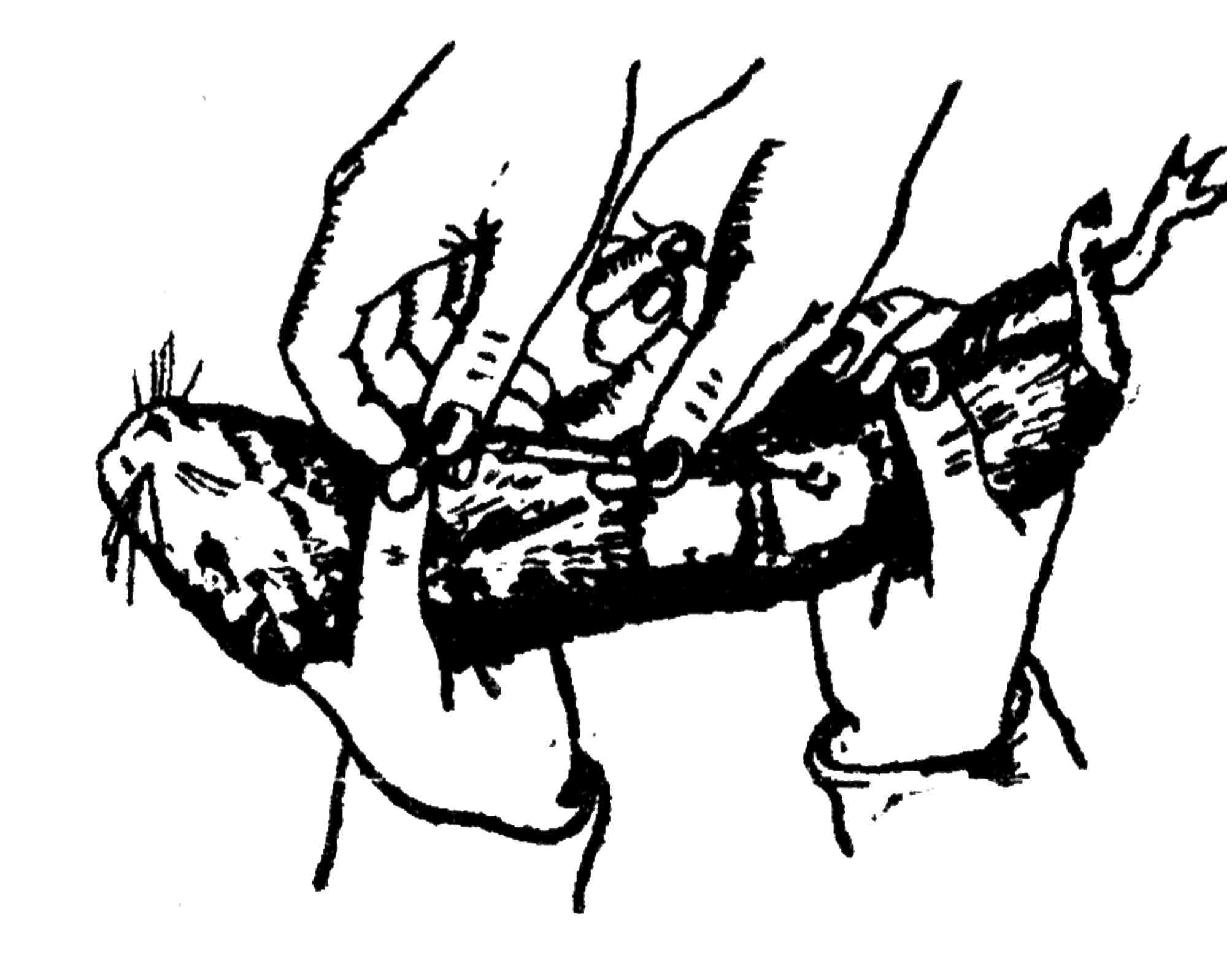
Рис. 36. Внутрикожное заражение морской свинки
При накожном способе заражения исследуемый материал втирают стеклянной палочкой в неповрежденную или скарифицированную кожу. Скарификацию (насечки) производят скальпелем или пером для оспопрививания. Материал втирают в места, недоступные для слизывания (на спине, ближе к голове).
Внутрибрюшинное заражение. Материал вводят в левую нижнюю треть живота. Животное держат вниз головой, чтобы кишечник переместился к диафрагме. Кожу прокалывают иглой под острым углом, затем устанавливают шприц под прямым углом. Толчкообразным движением прокалывают брюшную стенку и вводят содержимое шприца (рис. 37).
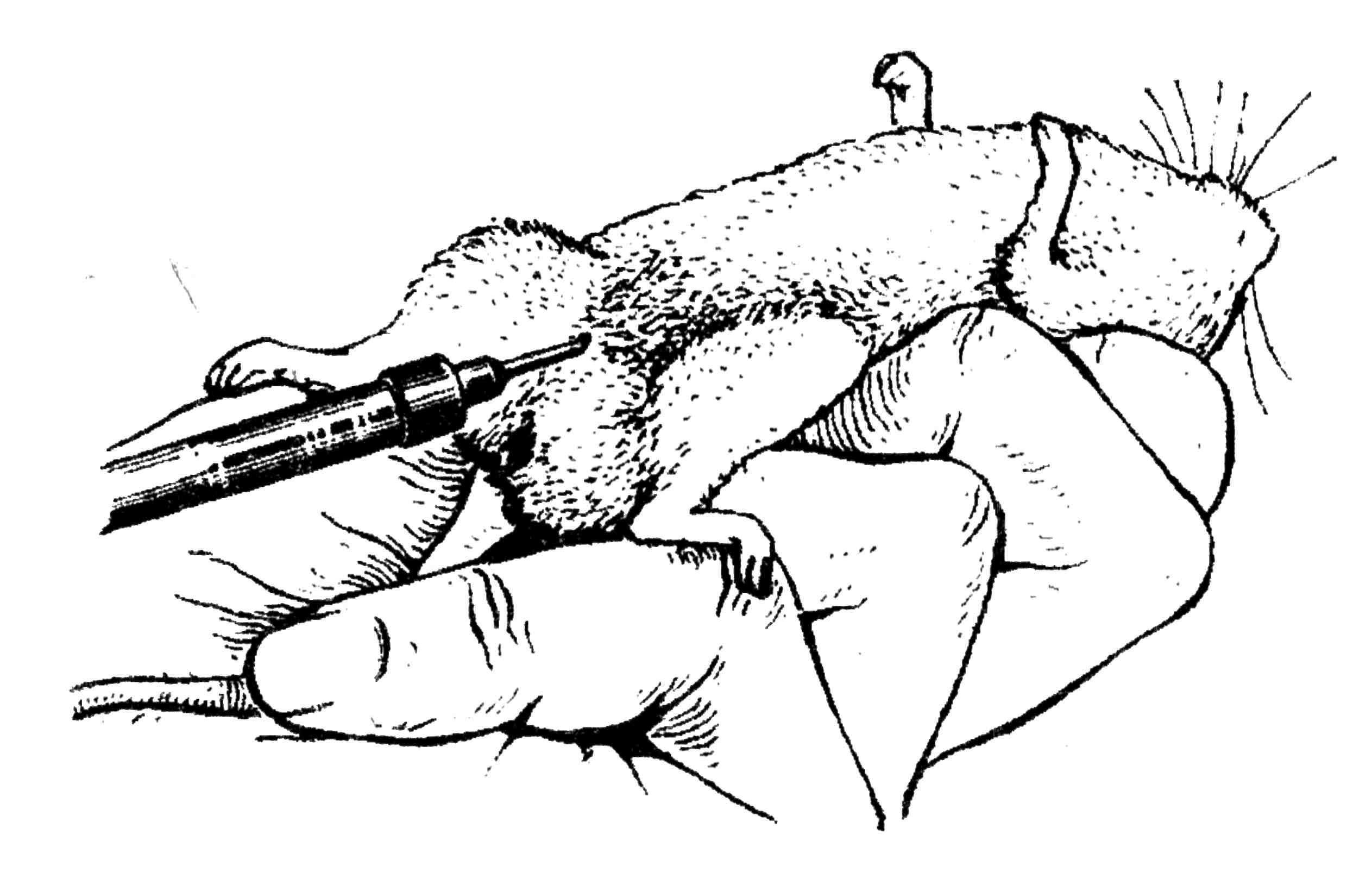
Рис. 37. Внутрибрюшинное заражение белой мыши
Методика внутривенного заражения зависит от вида животного. У кроликов материал вводят в краевую ушную вену. После удаления шерсти вдоль наружного края уха для лучшего кровенаполнения зажимают вену у основания уха, растирают, поколачивают щелчками место введения или смазывают ксилолом. Перед введением материала сдавливание вены прекращают. Иглу вводят в вену под острым углом по направлению тока крови. При попадании иглы в вену жидкость свободно поступает в кровь при легком надавливании на поршень шприца. Если игла не в вене, жидкость поступает с трудом, образуя в месте введения вздутие. В таком случае следует извлечь иглу и ввести ее ближе к основанию уха. Перед извлечением иглы прижимают вену стерильной ватой и не снимают ее до прекращения кровотечения (рис. 38).
Мышей и крысам материал вводят в хвостовые вены. Помощник держит мышь и сдавливает корень хвоста. Для более полного кровенаполнения сосудов хвост погружают на 1-2 минуты в воду, нагретую до 50°. Прокол вены лучше производить у основания хвоста, где сосуды расположены поверхностно или в нижней его трети, где вены шире. Во время инъекции сдавливание у корня хвоста прекращается.
Морским свинкам материал вводят в вену внутренней поверхности бедра, предварительно разрезают кожу и отсепарируют вены. После инъекции на рану накладывают швы.
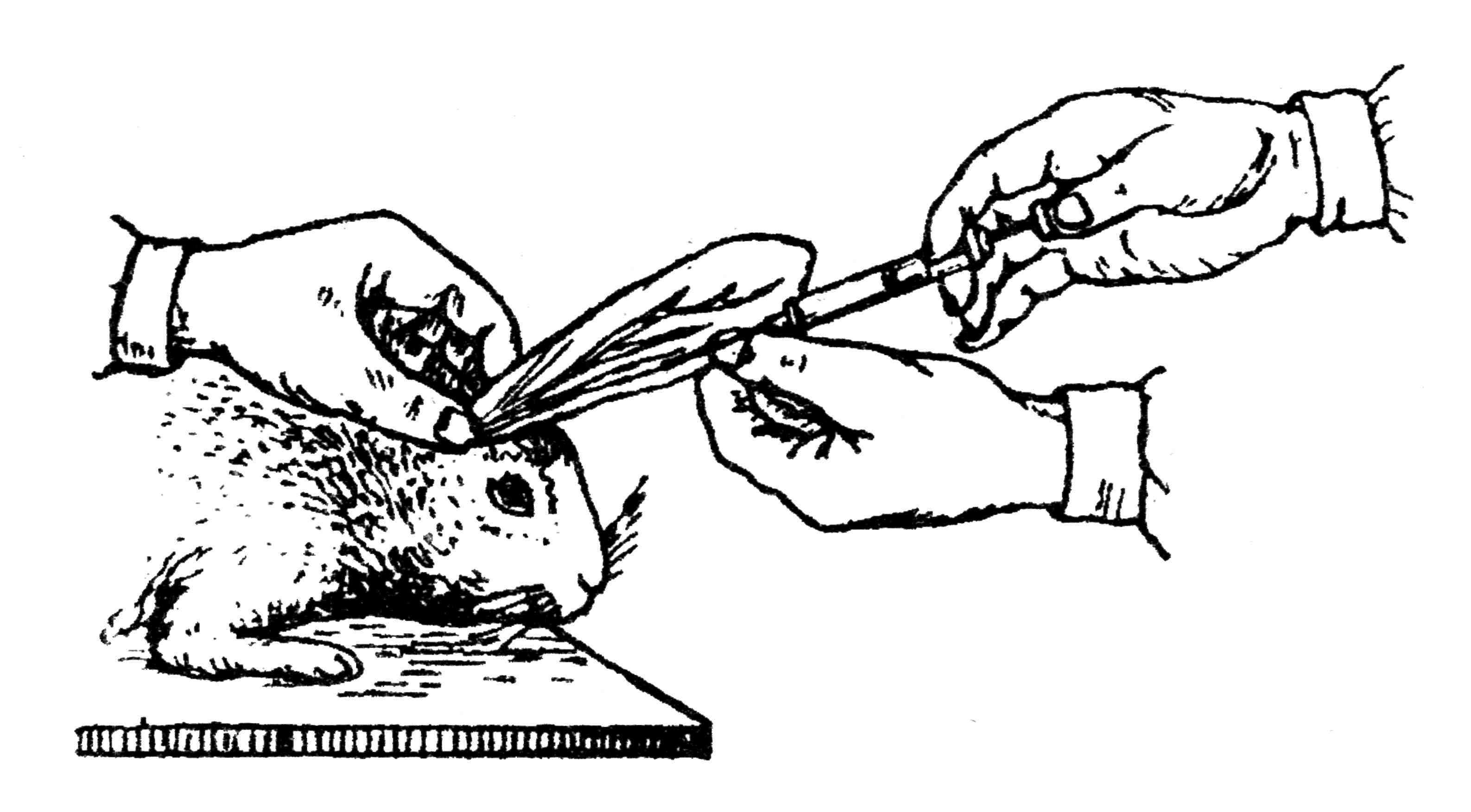
Рис. 38. Внутривенное заражение кролика
Для введения материала в сердце или взятия крови из сердца кролика или морскую свинку фиксируют таким образом, чтобы голова животного находилась слева от экспериментатора. Шерсть с левой стороны груди выстригают, кожу дезинфицируют спиртом или йодом. Большим пальцем левой руки экспериментатор слегка надавливает на правую сторону грудной стенки животного, а указательным пальцем нащупывает толчок сердца и одновременно определяет положение ребер. Игла вводится в месте толчка в межреберный промежуток перпендикулярно грудной клетке. Если игла находится в полости сердца, в шприц толчками поступает кровь, после чего можно вводить материал или набирать кровь. Если кровь не поступает, иглу извлекают и производят прокол вены вновь, тщательно проверив место толчка (нельзя изменять направление иглы, не извлекая ее, так как можно разорвать мышцы сердца). После инъекции кожу дезинфицируют йодной настойкой. Обычно при взятии больших порций крови животному вводят под кожу стерильный раствор хлористого натрия в количестве, равном взятой крови.
Заражение субдуральное (под твердую мозговую оболочку), интрацеребральное (внутрь мозга), интраокулярное (в переднюю камеру глаза), через пищеварительный тракт, в дыхательные пути производят в тех случаях, когда иной путь введения не вызывает у экспериментального животного типичного инфекционного процесса.
13.2. Определение вирулентности микробов
При изучении свойств патогенных микробов в ряде случаев производят определение их вирулентности. Это необходимо для идентификации микробов, выделенных от больных, носителей и из внешней среды, характеристики силы вакцины, выявление напряженности иммунитета у животных и т.д.
Вирулентность микробов выражается МLD – минимальной смертельной дозой, то есть минимальным количеством микробов, вызывающих гибель животного определенного вида, и LD50 – дозой, вызывающей гибель 50 % зараженных животных.
Определение МLD. Для этой цели пользуются культурами, выращенными на плотных или жидких питательных средах. Культуры на плотных питательных средах смывают 0,85%-ным раствором поваренной соли и устанавливают определенное количество микробных тел в 1 мл, пользуясь оптическим стандартом. Культуры, выращенные на жидких питательных средах, разводят то или иное количество раз. Минимальная смертельная доза может резко варьировать в зависимости от вида и штамма микроба, а также вида животного, места введения и других факторов. Например, для определения вирулентности возбудителя пастереллеза; 18-часовую агаровую культуру Р. multocida смывают физиологическим раствором и устанавливают содержание микробов по оптическому стандарту до 1 млрд. в 1 мл.
В первый ряд пробирок наливают пипеткой 1,8 мл физиологического раствора.
Затем в первую пробирку вносят 0,2 мл из основного разведения культуры микроба, получая разведение 500 млн. микробных тел.
Далее делают разведение 250, 125, 62,5 млн/мл и т.д., каждое разведение готовят отдельной стерильной пипеткой.
Содержимое каждой пробирки вводят подкожно белым мышам массой 18-20 г.
За животными наблюдают в течение 10 дней, отмечая погибших животных. Минимальное количество микробов, вызвавшее гибель белой мыши, принимается за МLD.
Определение LD50. В настоящее время этот метод определения вирулентности микробов более достоверный и менее зависит от индивидуальной чувствительности животного.
Из культуры бактерий или вирусов делают десятикратные разведения. Каждое разведение вводят нескольким животным.
Очень трудно подобрать такое разведение, которое вызывало бы гибель 50 % животных, поэтому в настоящее время применяется метод статистического учета и исчисления LD50, предложенный Л. Ридом и X. Менчем. При исследовании материала, разведенного от 10-1 до 10-8, потребуется 8 групп животных. После прекращения наблюдения отмечают количество погибших животных в каждой группе и определяют LD50 при помощи специальных таблиц.
Проведение дермонекротической пробы.
Она применяется для выявления некротоксина, содержащегося в фильтрате бульонной культуры.
Для этого у кролика белой масти на боковой поверхности выбривают участок кожи и дезинфицируют, внутрикожно вводят 0,2 мл исследуемого материала. При положительной пробе вначале отмечают гиперемию, затем отек и в последнюю очередь некроз (обычно через 2 – 3 дня).
13.3. Бактериологическое исследование трупа
Основной целью бактериологического исследования трупа является обнаружение микроба, вызвавшего гибель животного, выделение его в чистой культуре и определение места локализации возбудителя.
При вскрытии трупа животного необходимо соблюдать ряд условий.
1. Вскрытие следует производить как можно быстрее после гибели животного, так как кишечная флора быстро проникает в ткани, кровь, органы. При комнатной температуре это происходит через 10-18 часов, а при температуре холодильника – через 20-22 часа. Труп до вскрытия сохраняют на холоде.
2. Вскрытие трупа, взятие материала для исследования производят с соблюдением правил асептики. Инструменты используют только стерильные и меняют при вскрытии каждой полости или каждого органа.
3. Необходимо исключить возможность заражения работающих и загрязнение окружающих предметов. Перед вскрытием трупы мелких животных погружают в дезинфицирующий раствор, у более крупных животных шерсть увлажняют этим раствором. Вскрывают трупы на хорошо выстроганной окрашенной доске, помещенной в металлическую ванночку или кювету с дезинфицирующим раствором. После окончания вскрытия труп уничтожают.
4. Все данные вскрытия обязательно протоколируют. Записи должны быть подробными и четкими. В протоколе отмечают дату заражения и описание материала, которым производили заражение.
Порядок вскрытия. Труп кладут спиной на доску, растягивают в стороны лапы и фиксируют препаровальными иглами или острыми гвоздями (рис. 39). До фиксирования производят осмотр трупа. Отмечают изменение наружных покровов, выпадение шерсти и изменение цвета кожи (при злокачественном отеке и т.п.).
Перед вскрытием инструменты переносят из стерилизатора в банку со спиртом и ватой на дне, перед употреблением их обжигают в пламени.
Вскрытие наружных покровов. Вскрытие начинают с продольного разреза кожи от нижней челюсти до лобка. Отсепарируют ее по сторонам, делают надрезы по направлению к конечностям и откидывают в стороны лоскутки кожи, обнажая всю переднюю поверхность. Отмечают состояние подкожной клетчатки и лимфатических узлов. Если последние изменены, делают посевы на питательные среды и препараты-отпечатки (методом разреза прикасаются к предметному стеклу). Использованные инструменты погружают в дезинфицирующий раствор.