ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1118
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Определить, при каком сочетании объектива и окуляра проводилась микроскопия?
А. х90 и х7.
Б. х90 и х10.
В. х90 и х15.
Г. х40 и х15.
4. При микроскопии препарата с объективом х90 и окуляром х10 получено нерезкое изображение.
Найти ошибку, которая была допущена при проведении микроскопии.
А. Конденсор не поднят до конца.
Б. Микроскопия проводится без масла.
В. Использовано вогнутое зеркало.
5. При микроскопии препарата с использованием объектива х90 и окуляра х10 выявлена слабая освещенность поля зрения.
Ваши действия по устранению этого недостатка:
А. Поднять конденсор до уровня предметного столика.
Б. Проверить и открыть диафрагму конденсора.
В. Нанести на препарат иммерсионное масло.
6. Размеры бактерии измеряются в микрометрах (мкм), один мкм составляет:
А. 1/10 мм.
Б. 1/100 мм.
В. 1/1000 мм.
7. Структурные образования бактериальной клетки измеряются нанометрах (нм), один нм составляет:
А. 1/10 мкм.
Б. 1/100 мкм.
В. 1/1000 мкм.
8. Завершив микроскопию с использованием иммерсионной системы, необходимо сделать:
А. Поднять макровинтом тубус из масла и убрать препарат.
Б. Убрать препарат, поднять тубус микроскопа макровинтом.
9. После работы с микроскопом с использованием иммерсионной системы необходимо сделать:
А. Макровинтом поднять тубус, убрать препарат, салфеткой снять с объектива масло, поставить объектив х8, подложить салфетку под объектив, опустить тубус и конденсор.
Б. Убрать препарат, макровинтом поднять тубус, снять с объектива масло, поставить объектив х8, подложить салфетку под объектив, опустить тубус и конденсор.
В. Макровинтом поднять тубус, убрать препарат, поставить объектив х8, подложить салфетку под объектив, опустить тубус и конденсор.
10. При микроскопии препарата с иммерсионным объективом допущена ошибка, которая привела к получению нерезкого изображения. Найдите способ исправления ошибки.
А. Нанести на препарат иммерсионное масло.
Б. Вращать макровинт.
В. Вращать микровинт на полоборота в ту или иную сторону.
11. Установлено, что стафилококки при микроскопировании имеют диаметр, равный 1,35 мм, в действительности этот микроорганизм имеет диаметр, равный 1 мкм. Определите, при каком сочетании объектива и окуляра проводилась микроскопия?
А. Объектив х40, окуляр х15.
Б. Объектив х90, окуляр х7.
В. Объектив х90, окуляр х10.
Г. Объектив х90, окуляр х15.
12. Конденсор микроскопа предназначен для:
А. Уменьшения светового потока.
Б. Фокусирования световых лучей на плоскости рассматриваемого объекта.
В. Увеличения изображения объекта.
13. Микровинт микроскопа предназначен для:
А. Фокусировки при работе с объективом х40.
Б. Фокусировки при работе с объективом х90.
В. Перемещения препарата при микроскопии при работе с объективом х90.
14. При работе с микроскопом при увеличении х90 микровинт не вращается. Ваши действия по восстановлению работы микровинта:
А. Микровинт вращать в обратную сторону, добиваясь положения белой точки на середине между двумя белыми линиями.
Б. Поднять макровинтом объектив х90 из масла, вращая микровинт в обратную сторону, добиться положения белой точки на середине между двумя белыми линиями.
В. Обратиться за помощью к преподавателю.
Тема 3. Техника приготовления препаратов для микроскопии (3.1). Бактериологические краски (3.2). Простой метод окрашивания препаратов (3.3). Изучение основных форм бактерий (3.4)
ЦЕЛЬ ЗАНЯТИЯ. Овладеть методикой приготовления препаратов для микроскопии и их окраски простым методом. Ознакомиться с основными формами бактерий.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Пробирки со взвесью бактериальных культур (кишечная палочка, стафилококки, вакцинный штамм бациллы сибирской язвы). Набор растворов красок – разведенный фуксин, щелочная метиленовая синь; предметные стекла, спиртовки, бактериологические петли, микроскопы.
Таблицы, схемы.
3.1. Техника приготовления препаратов для микроскопии
Препараты для микроскопии готовят на предметных стеклах. Для работы необходимо иметь специально приготовленные предметные и покровные стекла, которые должны быть чистыми и обезжиренными.
Новые стекла моют в теплой воде с мылом. Для обезжиривания их помещают на 2-3 дня в смесь Никифорова (равные объемы спирта и эфира в сосуде с притертой пробкой).
Если предметные или покровные стекла были в употреблении, их обрабатывают хромовой смесью, промывают водой, кипятят 30-40 мин в 5%-ном растворе соды.
Необработанные стекла можно обезжирить, натерев их мылом, а затем почистить сухой тканью. Капля воды, нанесенная на хорошо обезжиренное стекло, растекается равномерно. На недостаточно обезжиренном стекле вода распадается на мелкие капли.
В зависимости от характера исследуемого материала при его взятии используют бактериологическую петлю или пастеровскую пипетку. Петлю делают из платиновой или нихромовой проволоки длиной 5-6 см и закрепляют в петледержателе. На конце проволоки делают петлю. Петлю держат, как карандаш. Рабочую часть петли стерилизуют в пламени горелки в вертикальном положении, сначала конец петли, затем петледержатель.
Приготовление окрашенного препарата (мазка) состоит из нескольких этапов (рис. 7): 1) приготовление; 2) высушивание; 3) фиксация; 4) окраска.
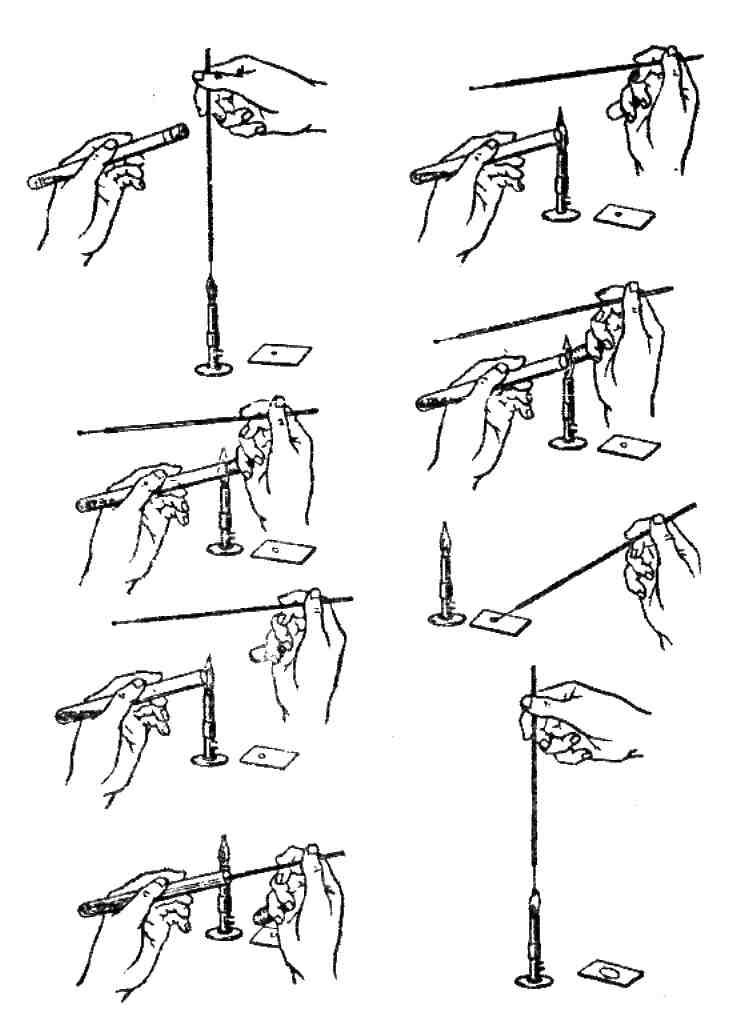
Рис. 7. Схема приготовления препарата-мазка
1. Приготовление мазка
На предметном стекле с обратной стороны восковым карандашом обозначают место мазка диаметром 2-3 см.
Из культуры, выращенной на жидкой питательной среде, стерильной петлей берут каплю материала и распределяют на предметном стекле. Из культур, выращенных на плотной среде, петлей с поверхности берут небольшое количество материала, размешивают в заранее нанесенной на предметное стекло капле физиологического раствора или воды и размазывают по стеклу.
Из плотного патологического материала (печень, почки, селезенка и др.) делают мазки-отпечатки. Для этого стерильными ножницами отрезают кусочек органа и прикладывают к предметному стеклу, делая один или несколько отпечатков.
2. Высушивание мазка
Мазки высушивают на воздухе при комнатной температуре или в термостате.
3. Фиксация мазка
Мазки фиксируют после полного высыхания с целью:
1) закрепить мазок на стекле;
2) убить бактерии;
3) убитые бактерии лучше воспринимают краску.
Фиксацию мазков осуществляют одним из двух способов: физическим и химическим. Физический метод заключается в трехкратном проведении обратной стороной мазка через пламя спиртовой горелки, задерживая в пламени на 1-2 секунды.
При химическом способе мазок погружают в жидкости:
а) этиловый спирт 96°-ный на 10-15 минут, или
б) смесь равных объемов спирта и эфира на 10-15 мин, или
в) ацетон - 5 минут.
4. Окраска мазка
Бактерии различно относятся к красителям, эти свойства называют тинкториальными.
3.2. Бактериологические краски
Наиболее широко в микробиологии используют анилиновые красители основного и нейтрального характера. Для окраски мазков применяют красители:
1) красные (фуксин основной, нейтральрот);
2) синий (метиленовый синий);
3) фиолетовые (генцианвиолет, кристаллвиолет, метилвиолет);
4) зеленые (бриллиантовая зелень, малахитовая зелень).
Все применяемые красители поступают в лаборатории в сухом порошкообразном или кристаллическом виде. Из таких красителей, как основной фуксин, генцианвиолет, метиленовая синь, заранее готовят насыщенные спиртовые растворы.
Р е ц е п т ы к р а с и т е л е й:
1. Карболовый фуксин Циля
-
Основной фуксин
1 г
Спирт 95°-ный
10 мл
Карболовая кислота кристаллическая
5 г
Глицерин
5 – 6 капель
Вода дистиллированная
100 мл
Через 48 ч краситель фильтруют. Срок хранения длительный.
2. Разведенный фуксин Пфейффера
-
Фуксин Циля
1 мл
Вода дистиллированная
9 мл
Срок хранения не более
1 суток.
3. Щелочная метиленовая синь Лефлера
-
Насыщенный раствор сини спиртовой
30 мл
1 %-ный раствор едкого натра или калия
1 мл
Вода дистиллированная
100 мл
Срок хранения длительный.
4. Карболовый генцианвиолет
-
Насыщенный спиртовой раствор
Генцианвиолета
10 мл
5%-ный раствор карболовой кислоты
100 мл