ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1179
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Осветительный аппарат состоит из конденсора (5), зеркала (10), ирисовой диафрагмы (9). Он предназначен для наилучшего освещения препарата. С помощью зеркала лучи света, исходящие от источника света, направляются в конденсор, концентрирующий свет в своем фокусе. Поверхность зеркала с одной стороны плоская, с другой вогнутая. При естественном источнике света применяется вогнутое зеркало, при искусственном (осветитель, электролампа) – плоское.
Конденсор с ирисовой диафрагмой представляет собой систему оптических линз и служит для собирания лучей света и направления их с помощью винта (8). При опускании конденсора поле зрения несколько затемняется, при поднятии – освещается. Ирисовая диафрагма служит для регулирования интенсивности света, которое осуществляется с помощью рычага расширением или сужением отверстия, пропускающего свет к конденсору.
Выпускаются также дополнительные приспособления к микроскопу, которые позволяют максимально использовать все его возможности, облегчают условия работы и значительно расширяют диапазон применения. В микробиологии часто используются следующие приспособления:
Конденсор темного поля.
Фазово-контрастное приспособление КФ-1, КФ-4 и другие модели.
Бинокулярная насадка, приближающая микроскопию к условиям естественного зрения.
Осветители ОИ-7, ОИ-19 и другие модели, обеспечивающие оптимальное и стабильное освещение, интенсивность света которых регулируется реостатом.
Окуляр-микрометр и объект-микрометр, предназначенные для измерения микроскопических объектов.
Нагревательный столик, который устанавливается вместо предметного столика микроскопа для обеспечения постоянной температуры 37°С. Применяется для длительного наблюдения за живыми микроорганизмами.
Рисовальный аппарат для высококачественной зарисовки препарата, с помощью которого можно одновременно видеть изображение объекта и бумаги, расположенной на столе вблизи микроскопа, и обводить на бумаге контуры объекта.
Цветные, нейтральные и тепловые оптические светофильтры устанавливаются между источником света и микроскопом и применяются при микрофотографии и специальных методах микроскопии.
Микрофотонасадки МФН-1, МФН-3, и другие модели для фотографирования микроскопических объектов.
Микроустановка для цейтраферной (прерывистой) микрокиносъемки, применяющаяся в сочетании с фазово-контрастной микроскопией, позволяет изучить динамику развития и размножения микроорганизмов, влияние на них разных факторов и многие другие вопросы.
Правила работы со световым микроскопом:
Установить наилучшее освещение поля зрения микроскопа, для чего:
- поставить объектив х8 на 1-1,5 см выше от уровня предметного столика микроскопа,
- поднять конденсор до уровня предметного столика (диафрагму открыть),
- использовать плоское (вогнутое) зеркало и найти наилучшее освещение.
Установить препарат, укрепив клеммами.
Нанести каплю иммерсионного масла в центр препарата.
Заменить объектив х8 на х90.
Погрузить объектив х90 в масло с помощью макровинта.
Наблюдая в окуляр, установить макровинтом какое-либо изображение.
С помощью микровинта, вращая его на пол-оборота в ту или иную сторону, установить четкое изображение.
После окончания работы привести микроскоп в порядок для хранения:
Поднять макровинтом тубус микроскопа.
Убрать препарат.
Салфеткой снять с объектива х90 масло и установить объектив х8.
Опустить конденсор.
Подложить салфетку под объектив и опустить тубус микроскопа.
2.2. Виды микроскопии и их назначение
Для микробиологических исследований используют различные виды микроскопии: световую, люминесцентную, темнопольную, фазово-контрастную, электронную.
Наиболее распространенным методом является световая (оптическая) микроскопия.
В настоящее время отечественная промышленность выпускает самые разнообразные биологические микроскопы: МБИ-1, -2, -3, -4 (микроскоп биологический исследовательский), МБР (рабочий), люминесцентные микроскопы (МЛ-1, МЛ-2), электронные.
При микроскопировании изучают морфологию микроорганизмов, их тинкториальные свойства (отношение к красителям), а также структурные особенности (споры, капсулы), подвижность и др.
Микроскопия с фазово-контрастным устройством. С помощью фазово-контрастного устройства различия в фазе световых лучей при прохождении их через прозрачные объекты превращаются в амплитудные, в результате чего объекты становятся контрастными. Метод фазового контраста позволяет увидеть прозрачные объекты более четко (контрастно), но не увеличивает разрешающей способности микроскопа (рис.3). Основная ценность этого метода состоит в том, что он дает возможность наблюдать живые объекты без их фиксации и окрашивания.
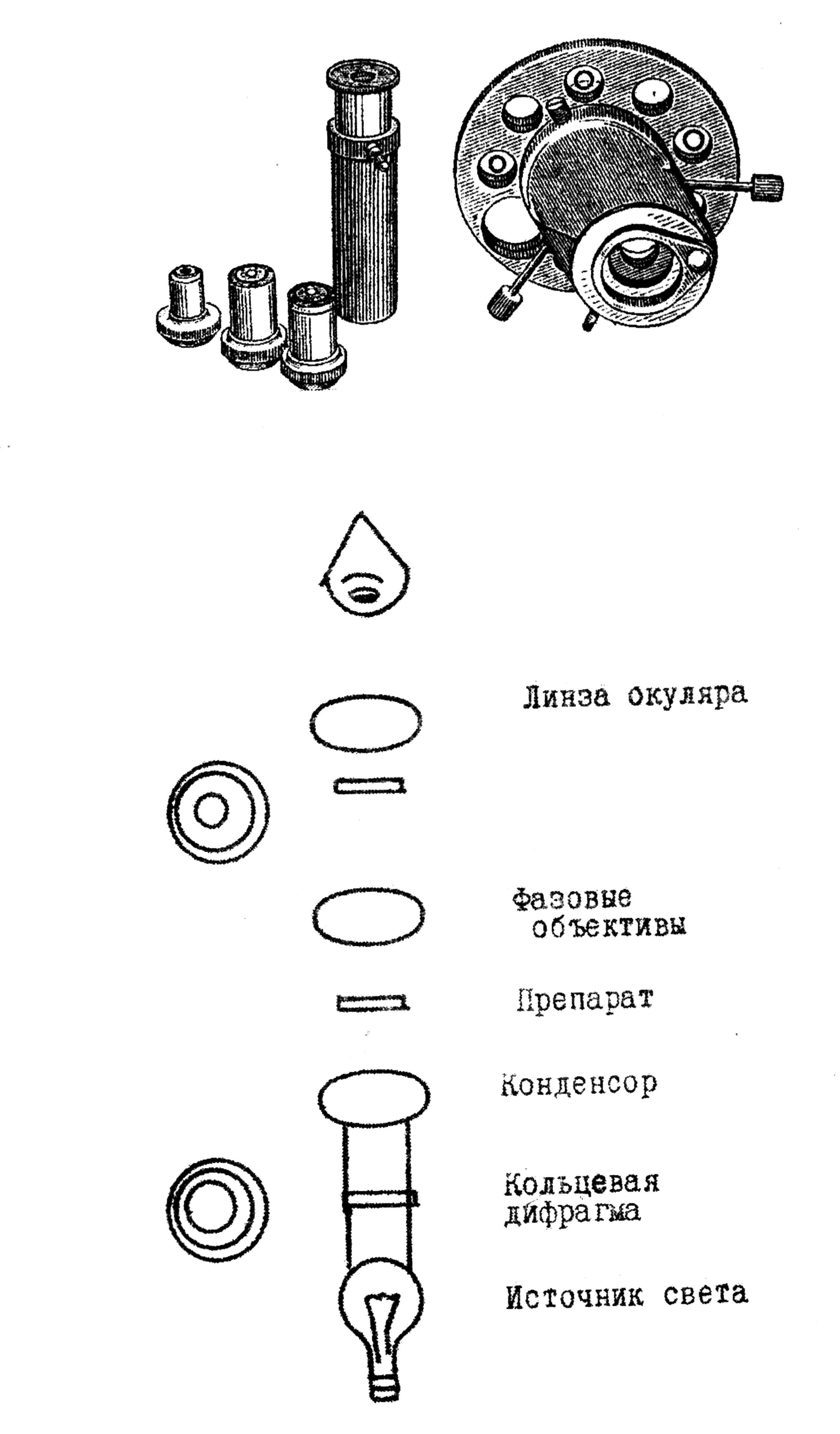
Рис. 3. Фазово-контрастное устройство: А – общий вид; Б – принципиальная схема работы фазово-контрастного микроскопа
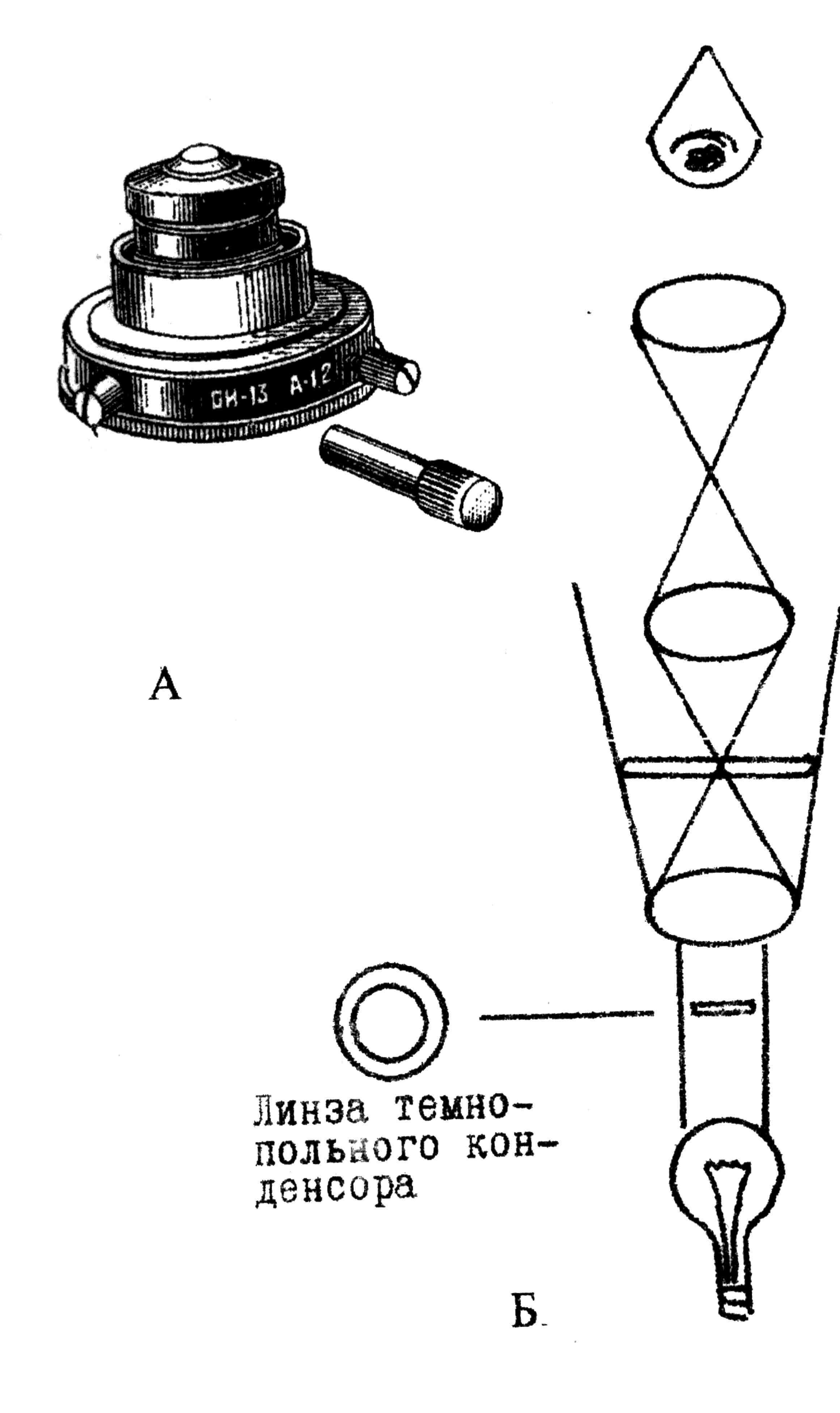
Рис. 4. Микроскопия в темном поле: А – внешний вид темнопольного конденсора ОИ-13; Б – принципиальная схема светового микроскопа с темнопольным конденсором
Фазово-контрастное устройство представляет собой приставку к микроскопу и состоит из специальных фазовых объективов, дающих различное увеличение, конденсора с набором кольцевых диафрагм, каждая из которых соответствует определенному объективу, и вспомогательного микроскопа. Все фазовые объективы имеют на оправе букву «Ф».
Микроскопия в темном поле. Микроскопия в темном поле основана на освещении объекта косыми лучами света (рис. 4). Лучи не попадают в объектив и остаются невидимыми для глаза, поэтому поле зрения выглядит совершенно черным. Если препарат содержит микроорганизмы, то косые лучи в определенной степени отражаются от их поверхности и, отклоняясь от своего первоначального направления, попадают в объектив. В этом случае на интенсивно черном поле видны ослепительно яркие светящиеся объекты. Такое освещение достигается применением специального темнопольного конденсора, имеющего затемненную среднюю часть. Поэтому центральные лучи света, идущие от зеркала, задерживаются, а в плоскость препарата попадают только боковые лучи, отраженные от зеркальных поверхностей, расположенных внутри конденсора.
При микроскопировании в темном поле можно увидеть объекты за пределами видимости обычного микроскопа. Однако наблюдение объектов в темном поле позволяет различить только их контуры и не дает возможности рассмотреть внутреннее строение.
Люминесцентная микроскопия. Люминесцентный микроскоп состоит из сильного источника ультрафиолетового света, светофильтров и биологического микроскопа (рис. 5) Между источником света и зеркалом микроскопа устанавливается сине-фиолетовый фильтр. Лучи света с короткой волной, попадая на препарат, возбуждают в нем свечение. На окуляр микроскопа ставят желтый фильтр, который отсекает сине-фиолетовые лучи и пропускает длинноволновые лучи, видимые глазом. В люминесцентной микроскопии большое значение имеет иммунофлюоресцентный метод с использованием специфических люминесцентных сывороток.
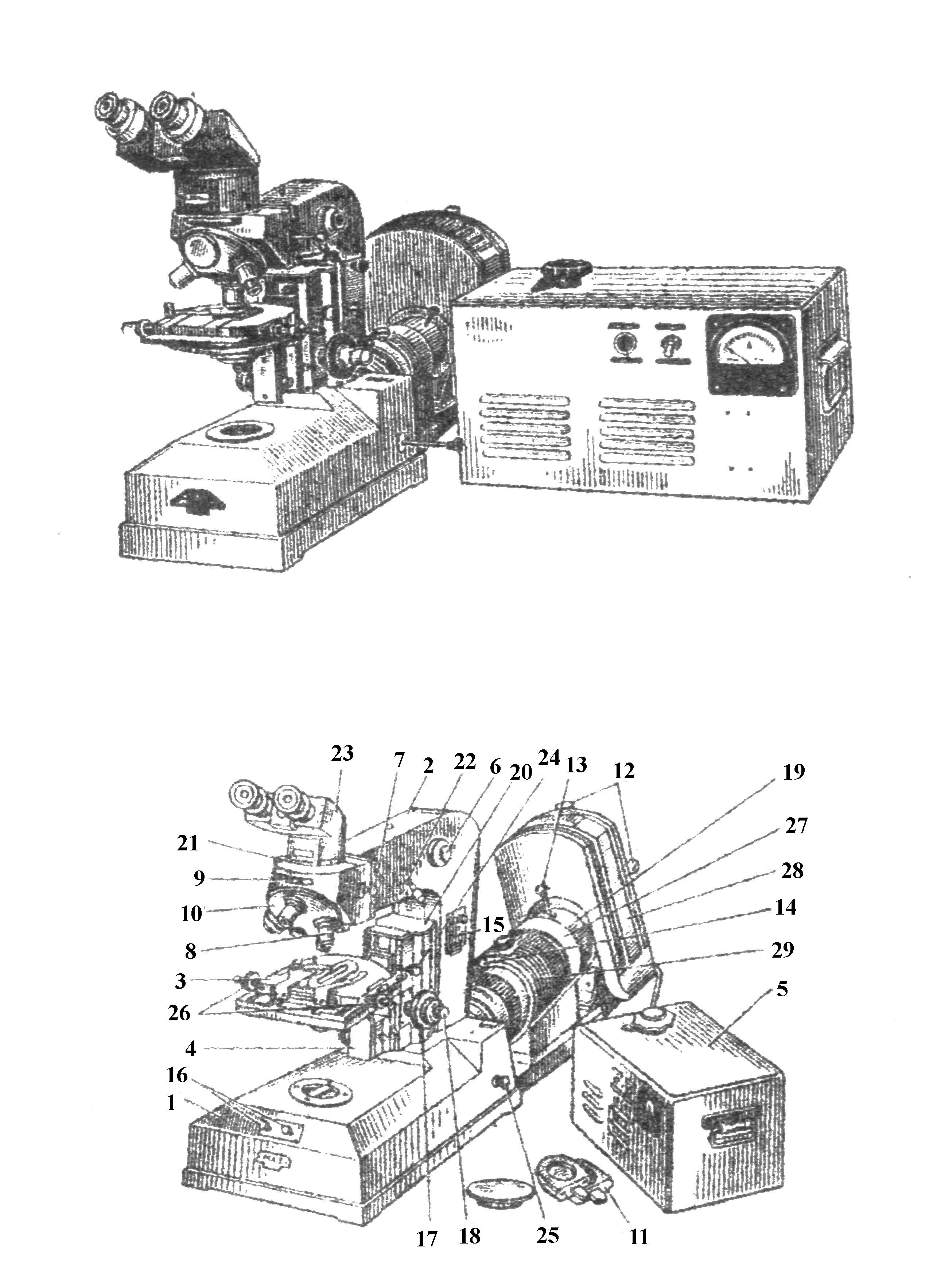
Рис. 5. Люминесцентный микроскоп МЛ-2:
а – общий вид; б – схема: 1 – основание микроскопа; 2 – тубусодержатель; 3 – предметный столик; 4 – кронштейн с конденсором; 5 – электропульт ПРЛ-5; 6 – рукоятка полевой диафрагмы; 7 – рукоятка для переключения освещения; 8 – револьверный диск с «запирающими» светофильтрами; 9 – рукоятка включения ахроматической линзы; 10 – револьвер объективов; 11 – светофильтры в оправах; 12 – винты для центровки лампы; 13 – рукоятка перемещения коллектора; 14 – рукоятка полевой диафрагмы; 15 – крышка гнезда светофильтров; 16 – винты для центрировки полевой диафрагмы; 17 – макрометрический винт; 18 – микрометрический винт; 19 – оправа коллектора; 20 – коробка с механизмами грубого и тонкого перемещения препарата; 21 – винт для крепления насадки; 22 – винты для центрировки полевой диафрагмы; 23 – бинокулярная насадка; 24 – рукоятка тормоза грубого движения; 25 – рукоятка для переключения освещения; 26 – рукоятка для перемещения препарата в горизонтальной плоскости; 27 – защитная втулка: 28 – корпус ртутной лампы; 29 – кювета с дистиллированной водой
Их приготовление основано на способности некоторых флюорохромов, например изоцианат флюоресцеина, вступать в химическую связь с сывороточными белками без нарушения их иммунологической специфичности.
При прямом иммунофлюоресцентном методе Кунса специфические антитела, связавшиеся с микробными антигенами, образуют комплексы, которые светятся при люминесцентной микроскопии препаратов. При непрямом методе вначале антиген обрабатывают гомологичными нефлюоресцирующими антителами, образуется комплекс антиген - антитело, для обнаружения которого применяют флюоресцирующую антивидовую сыворотку, соответствующую виду животного продуцента гомологичных антител. Антивидовые сыворотки получают, иммунизируя животных глобулинами животных тех видов, которые служат продуцентами антимикробных антител.
Электронная микроскопия. Электронная микроскопия делает возможным наблюдение объектов, размеры которых лежат за пределами разрешающей способности светового микроскопа (0,2 мкм). Электронный микроскоп применяется для изучения вирусов, тонкого строения различных микроорганизмов, макромолекулярных структур и других субмикроскопических объектов.
В электронных микроскопах световые лучи заменяет поток электронов, имеющий при определенных ускорениях длину волны около 0,005 нм, т.е. почти в 100 000 раз короче длины волны видимого света. Высокая разрешающая способность электронного микроскопа, практически составляющая 0,1-0,2 нм, позволяет получить общее полезное увеличение до 1 000 000 раз (рис. 6).
Наряду с приборами «просвечивающего» типа, используют «сканирующие» электронные микроскопы, обеспечивающие рельефное изображение поверхности объекта. Разрешающая способность этих приборов значительно ниже, чем у электронных микроскопов «просвечивающего» типа.
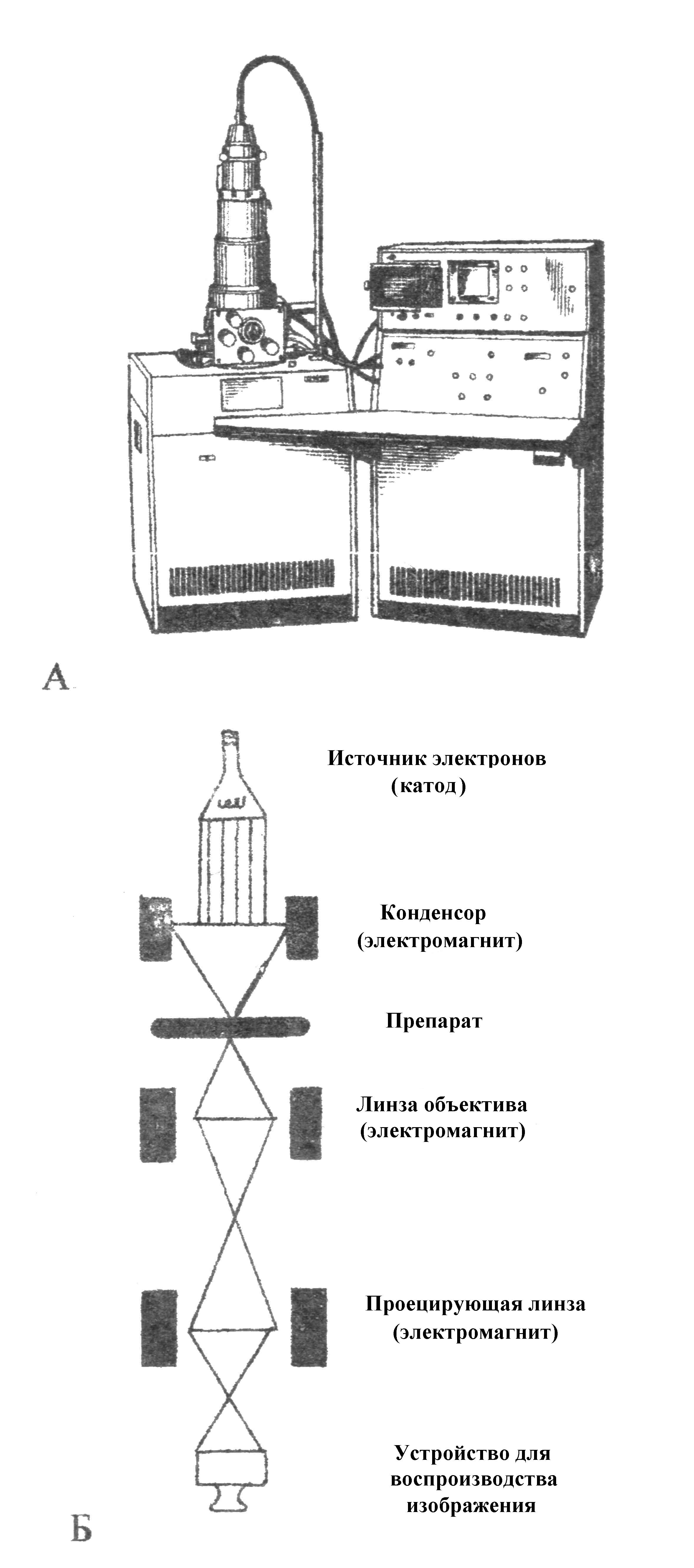
Рис. 6. Электронный микроскоп: А — внешний вид; Б — принципиальная схема электронного микроскопа
Задания для самостоятельной работы
1. Изучить устройство микроскопа, освоить правила работы с ним.
2. Провести просмотр готовых окрашенных препаратов-мазков. Микроскопическую картину зарисовать.
3. В ходе работы уяснить значение конденсора, диафрагмы и других оптических частей микроскопа. С этой целью провести микроскопию: а) без конденсора и с опущенным конденсором с использованием объективов х8, х40, х90 и окуляров х7, х10, х15; б) с прикрытой диафрагмой.
Вопросы для самоподготовки и контроля знаний
1. Иммерсионный масляный объектив от других объективов отличается: А. Черной полосой.
Б. Белой полосой.
В. Цифрой х90.
Г. Цифрой х40.
2. При микроскопии окрашенного препарата, приготовленного из культуры стафилококка, диаметр которого 1 мкм, получено изображение диаметром 0,9 мм. Определить, при каком сочетании объектива и окуляра проводилась микроскопия?
А. х90 и х7.
Б. х90 и х10.
В. х90 и х15.
Г. х40 и х15.
3. При микроскопии окрашенного препарата, приготовленного из культуры кишечной палочки, истинная длина которой 5 мкм, получено изображение палочки длиной около 4,5 мм.