ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1150
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Стерилизация текучим паром может производиться в автоклаве при незавинченной крышке и открытом выпускном кране. Текучим паром стерилизуют и одновременно уплотняют сыворотки, яичные и другие среды. Свертывание сыворотки происходит при 80-90° в течение часа в специальном двустенном свертывателе, покрытом теплоизоляционным материалом. На дно в наклонном положении укладывают пробирки со средами, аппарат накрывается вначале стеклянной крышкой, а затем металлической. Вода в аппарат наливается через отверстие, находящееся в верхней части, оно закрывается пробкой, в которую вставлен термометр. В настоящее время широко применяются аппараты с электрическим нагревом.
5. Тиндализация представляет собой дробную стерилизацию при температуре ниже 60°, предложенную Д.Тиндалем веществ, легко разрушающихся и денатурирующихся при 60-100° (сыворотки, витамины). Нагревание производится в специальных приборах с терморегуляторами или в обычных водяных банях повторно в течение 5-6 дней при температуре 56-58° по 1 часу.
6. Пастеризация (частичная стерилизация). Этот метод был предложен Л. Пастером и направлен на уничтожение бесспоровых форм, преимущественно патогенных видов, споры же сохраняются жизнеспособными. Методом пастеризации обезвреживают различные продукты однократным нагреванием до 65-70° в течение 1 часа или до 70-80° 5-10 мин. Молоко пастеризуют с целью освобождения его от молочнокислых и патогенных бактерий (возбудителей туберкулеза, бруцеллеза, стафилококкозов и др.). При пастеризации пива, вина, плодовых соков уничтожаются возбудители болезней этих напитков. Витамины и вкусовые качества продуктов сохраняются. Пастеризованные продукты хранят в условиях холодильника.
Б. Облучение электромагнитными волнами
Облучение электромагнитными волнами используют для дезинфекции, стерилизации термолабильных материалов.
1. Ультрафиолетовые (УФ) лучи длиной 250 и 270 нм. Применяют бактерицидные лампы, которые широко используют для обезвреживания воздуха в боксах, операционных и других помещениях.
Вегетативные формы более чувствительны к облучению, чем споры, которые в 3-10 раз более устойчивы.
2. Гамма- и рентгеновское облучение широко используют для стерилизации антибиотиков, гормонов, пластмассовых изделий разового применения (шприцы, чашки Петри, пипетки и др.).
3. Ультразвук может быть использован для обеззараживания молока, воды, других пищевых продуктов.
7.2. Химические методы
Применение этих методов сводится к профилактике микробного загрязнения питательных сред, вакцин, диагностических и лечебных сывороток путем включения в их состав различных химических консервантов.
Питательные среды можно консервировать хлороформом, толуолом, эфиром. До посева такие среды прогревают при 56° для освобождения от этих веществ.
В биопромышленности вакцины и лечебные сыворотки консервируют карболовой кислотой, доводя концентрацию до 0,25-0,5%, формалином - до 0,05%, мертиолятом – до 1:5000 – 1:10000.
Сыворотки консервируют борной кислотой, толуолом или глицерином.
Различные химические вещества в лабораторной практике получили широкое использование для дезинфекции. С этой целью применяют растворы карболовой кислоты (3-5%-ные), хлорамина (1-3%-ные), этиловый спирт (70°) и др.
К химическим методам относится и стерилизация газами. Стерилизующими газами являются: формальдегид, окись этилена и пропиолактон.
Преимущество газов как стерилизующих веществ состоит в том, что их применение не требует нагревания; кроме того, их можно применять для стерилизации больших объемов, например помещений. Однако при их использовании нужно соблюдать большую осторожность, так как они оказывают токсическое действие на животных и людей.
7.3. Механические методы
Они основаны на фильтрации жидкостей через мелкопористые бактериальные фильтры, которые задерживают видимые под микроскопом микроорганизмы. Через них свободно проходят вирусы и микоплазмы, поэтому данные методы следует признать как «частичную» стерилизацию.
Фильтрование – один из очень удобных методов стерилизации тех жидкостей, которые нельзя простерилизовать другими способами, например, сыворотку крови, питательные среды и др.
Наиболее широко в микробиологической практике используют фильтры-свечи и пластинчатые фильтры.
Фильтры-свечи (рис. 20) имеют форму цилиндра с толстыми стенками и с полостью внутри. Одна группа свеч (Беркефельда) изготавливается из инфузорной земли. По величине пор в порядке уменьшения они обозначаются буквами W, N, V.
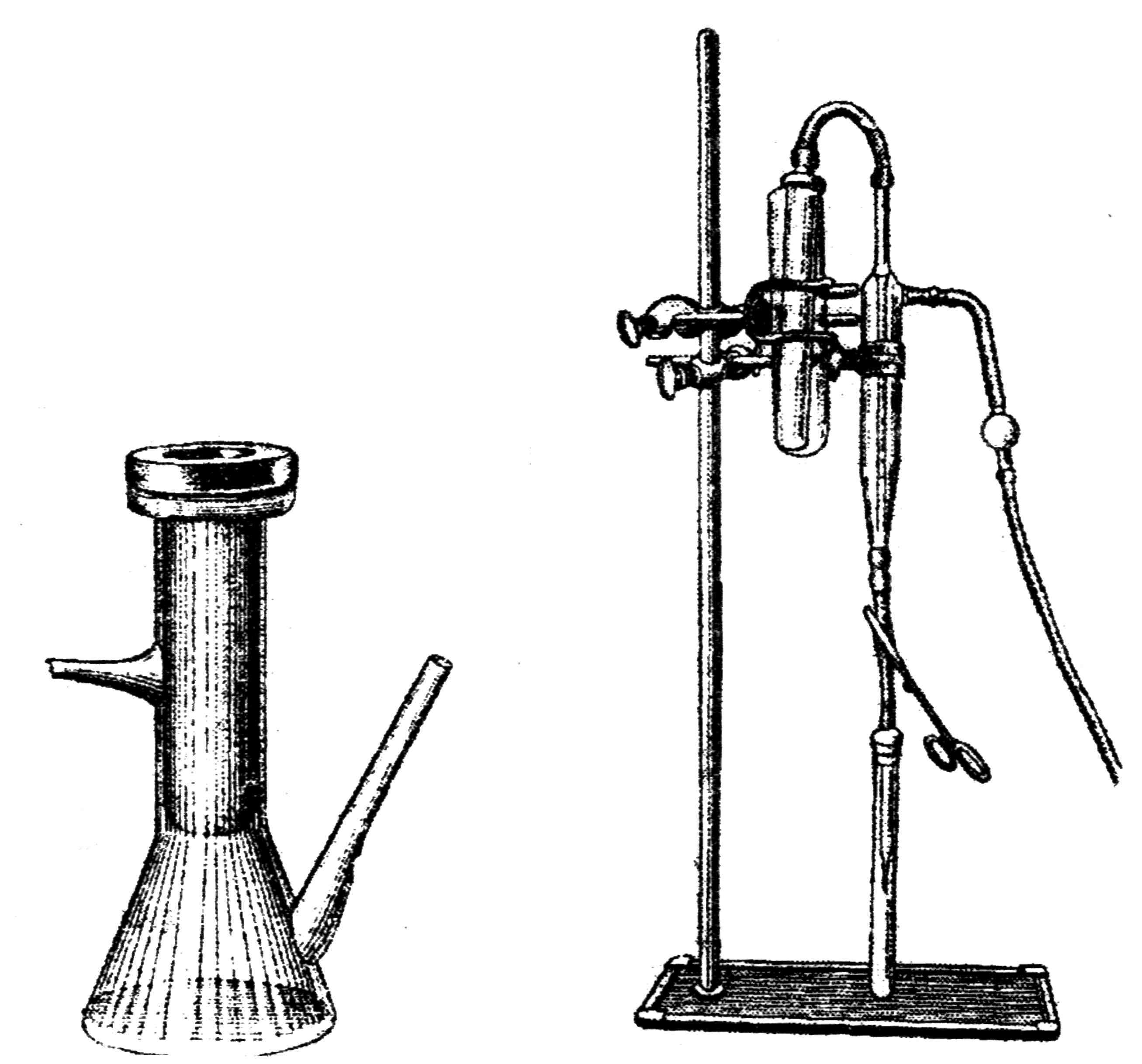
Рис. 20. Смонтированные свечи: фильтруемую жидкость наливают внутрь свечи (А), свеча погружается в фильтруемую жидкость (Б)
Другая группа свечей (Шамберлана) изготавливается из каолина с примесью песка и кварца. Они имеют различные размеры пор, условно обозначаемые L1, L2, L3, и т.д.
Фильтрация жидкостей через свечи может производиться двояко: под повышенным или пониженным давлением. В первом случае через свечу пропускают фильтруемую жидкость под давлением. Для этого жидкость наливают в сосуд, к которому присоединяют свечу. Нагнетательным насосом накачивают в этот сосуд воздух, который давит на жидкость; последняя поступает в полость свечи и просачивается через поры. Просочившаяся жидкость поступает в другой сосуд, в который вставлена свеча, а из него в присоединенную резиновой трубкой колбу. Давление, создающееся накачиванием воздуха, определяется манометром.
Во втором случае фильтрация производится с помощью уменьшения (создания вакуума) в сосуде, куда должна поступить профильтрованная жидкость. Свечу помещают в сосуд с фильтруемой жидкостью и соединяют трубкой с другим сосудом, из которого откачивается воздух. В результате откачивания воздуха создается значительное разрежение как в пустом сосуде, так и в полости соединенной с ним свечи. Жидкость из сосуда, в который помещена свеча, в силу разности давления устремляется в полость свечи (проходит через поры) и поступает в сосуд.
Перед фильтрацией обязательно должны быть простерилизованы свечи, трубки, соединяющие их с сосудами, и сами сосуды.
Отечественные асбестовые фильтры выпускаются с обозначениями Ф2 и СФ, последние являются стерилизующими мембранными фильтрами. Особенно широкое применение нашли так называемые мембранные фильтры, которые изготавливают из асбеста, бумаги, коллодия, ацетата целлюлозы. Обычно эти фильтры представляют собой диски различного диаметра. Такие диски пронизаны бесчисленным множеством мельчайших цилиндрических отверстий. В зависимости от способа изготовления фильтров диаметр этих отверстий может быть от 1 мкм до менее 0,005 мкм.
Мембранные фильтры монтируют в приборе Зейтца, который состоит из стакана (воронки) и колбы Бунзена, на тубус этой колбы надевают резиновый вакуумный шланг с ватным фильтром (рис. 21).
Собранный прибор завертывается в бумагу и стерилизуется ав-гоклавированием.
Жидкость, подлежащую стерилизации, наливают в воронку прибора, внутри которого создается вакуум и жидкость фильтруется, освобождаясь от бактерий.
Перед стерилизацией лабораторную посуду моют и сушат. Пробирки, флаконы, бутылки, колбы закрывают ватно-марлевыми пробками. Поверх пробирки на каждый сосуд надевают бумажный колпачок. Чашки стерилизуют завернутыми в бумагу по 2-4 штуки.
Для стерилизации пипеток в верхнюю часть каждой из них вкладывают кусочек ваты и затем заворачивают пипетки в плотную бумагу, нарезанную предварительно полосками шириной 2-2,5 см и длиной 50-70 см. На бумаге пишут объем завернутой пипетки. Пипетки можно стерилизовать также в специальных пеналах.
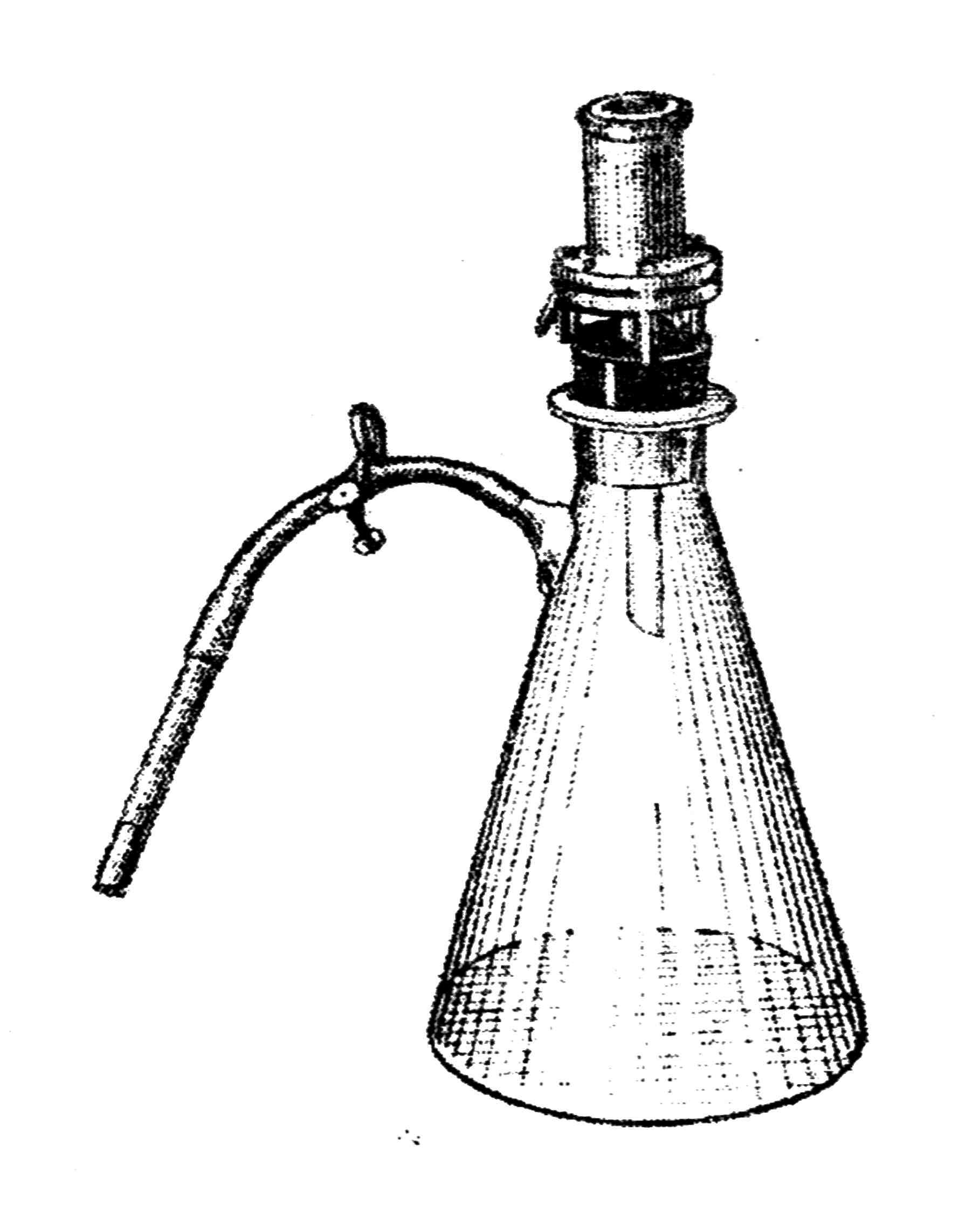
Рис. 21. Фильтр Зейтца с приемником
Мелкие металлические инструменты (петли, иглы, пинцеты, ножницы) стерилизуют прокаливанием в пламени непосредственно перед использованием. Изделия из резины (резиновые пробки, перчатки, шланги) стерилизуют автоклавированием. Предметы, изготовленные из термолабильных материалов: пластмасс, например, центрифужные пробирки, стерилизуют УФ-лучами, окисью этилена.
Задания для самостоятельной работы
1. Ознакомиться с устройством приборов и аппаратов для стерилизации.
2. Освоить технику работы с автоклавом, текучепаровым аппаратом, фильтровальными приборами.
3. Освоить технику подготовки чашек Петри, пипеток, другой посуды и простерилизовать в сушильном шкафу.
Вопросы для самоподготовки и контроля знаний
1. Стерилизацией называется:
А. Уничтожение патогенных микробов в объектах или окружающей среде.
Б. Комплекс мероприятий, направленных на предупреждение попадания микробов на (в) какой-либо объект.
В. Полное уничтожение в объекте всех жизнеспособных микробов и их спор.
2. К физическим методам стерилизации относят:
А. Гамма-лучи.
Б. Газовую стерилизацию.
В. Высокую температуру.
Г. Фильтрование через бактериальные фильтры.
Д. Ультрафиолетовые лучи.
3. В автоклаве при 1,0 атм (120°) в течение 15 мин стерилизуют:
А. Простые питательные среды (МПА и МПБ).
Б. Сывороточные среды.
В. Физиологический раствор.
Г. Среды с углеводами.
Д. Отработанный материал (культуры микробов, трупы лабораторных животных и т.д.)